WB实验流程视频:
http://www.abcam.cn/protocols/general-western-blot-protocol
裂解缓冲液
这些缓冲液可在 4 ℃ 下保存数周,或者以分装形式在 -20 ℃ 下保存长达 1 年。
Nonidet-P40 (NP40) 缓冲液
150 mM NaCl
1.0% NP40(可用 0.1% Triton X-100 替代)
50 mM Tris-HCl pH 8.0
蛋白酶抑制剂
RIPA 缓冲液(放射免疫沉淀试验缓冲液)
150 mM NaCl
1.0% NP-40 或 0.1% Triton X-100
0.5% 脱氧胆酸钠
0.1% SDS(十二烷基硫酸钠)
50 mM Tris-HCl pH 8.0
蛋白酶抑制剂
Tris-HCl 缓冲液
20 mM Tris-HCl pH 7.5
蛋白酶抑制剂
电泳、转膜、封闭缓冲液
Laemmli 2× 缓冲液/上样缓冲液
4% SDS
10% 2-巯基乙醇
20% 甘油
0.004% 溴酚蓝
0.125 M Tris-HCl
测定 pH 并调节至 pH 6.8。
电泳缓冲液(Tris-甘氨酸/SDS)
25 mM Tris 碱
190 mM 甘氨酸
0.1% SDS
测定 pH,pH 应为约 8.3。必要时进行调节。
转膜缓冲液(湿转)
25 mM Tris 碱
190 mM 甘氨酸
20% 甲醇
测定 pH,pH 应为约 8.3。必要时进行调节。
对于大于 80 kDa 的蛋白质,我们推荐加入最终浓度为 0.1% 的 SDS。
转膜缓冲液(半干转)
48 mM Tris
39 mM 甘氨酸
20% 甲醇
0.04% SDS
封闭缓冲液
5% 奶粉或 BSA(牛血清白蛋白)
加入 TBST 缓冲液中。混匀并过滤。过滤失败可能导致出现“斑点”,其中微小的黑色颗粒会在显色过程中污染印迹。
1. 制备细胞培养物裂解物
2. 制备组织裂解物
样品制备
上样和电泳
可能需要对时间和电压进行一些优化。我们推荐按照制造商的说明进行操作。应使用还原型凝胶,除非抗体数据表中推荐使用非还原性条件。
凝胶百分比取决于蛋白质的大小:
|
4 - 40 kDa |
20% |
|
12 - 45 kDa |
15% |
|
10 - 70 kDa |
12.5% |
|
15 - 100 kDa |
10% |
|
25 - 200 kDa |
8% |
将蛋白质从凝胶转移到膜上
如下制备转移堆叠体:

膜可以是硝酸纤维素或 PVDF,两者各具优点。用甲醇“活化”PVDF 1 分钟,并在制备堆叠体之前用转膜缓冲液冲洗 PVDF。可能需要对时间和电压进行一些优化。我们推荐按照制造商的说明进行操作。可在封闭步骤之前用丽春红染色法检查转膜。
所得膜可用于抗体染色。
抗体染色
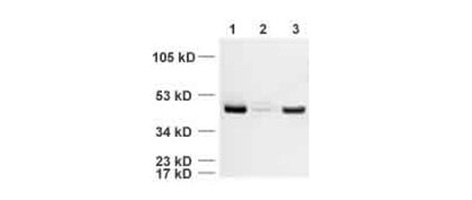
所有泳道:beta Actin 抗体 - 上样对照 (ab8227),稀释度为 1/5000
泳道 1:HeLa 全细胞提取物
泳道 2:酵母细胞提取物
泳道 3:小鼠脑组织裂解物
| 序号 | 最新资讯 | 浏览次数 | 发布时间 |
| 1 | WB流程视频及常用Buffer的配方 | 1305 | 2017-12-16 |
| 2 | WB 实验方案大全 | 3166 | 2017-12-15 |
| 3 | 免疫沉淀实验方案大全 | 989 | 2017-12-14 |
| 4 | ELISA 实验方案大全 | 1230 | 2017-12-14 |
| 5 | 免疫组化实验方案 | 2081 | 2017-12-14 |