免疫组织化学和免疫细胞化学
一、 IHC-石蜡技术指南 (IHC-P)
免疫组织化学 (IHC) 是确定组织切片上蛋白的存在与否及存在位置的一种方法。尽管这种方法在定量分析时灵敏度较免疫印迹法
ELISA 等 免疫测定方法低,但是它能观察到整个组织的情况。适用于评估癌症等疾病的发展及治疗情况。因此,从 IHC 获得的信息结合显微技术提供 了一副“宏图”,使来自其它方法的数据有据可依。
免疫组织化学染色是抗体识别靶抗原的过程。因为抗体是高度特异的,因此它只与组织切片上相应的蛋白结合。应用显色检测法即能看到抗 原-抗体反应,一种显色方法是将与酶结合的抗体作为底物在蛋白位点产生一种色素沉着,另外一种方法是荧光检测法,即将荧光染料结合到 抗体上,应用荧光显微技术检测。
IHC-P 涉及到固定(通常在中性甲醛溶液中固定)组织的染色,然后是在切割之前的石蜡包埋。下面是 IHC-P 技术的基本步骤:
- 组织的固定和包埋
- 切割并封固切片
- 脱蜡复水
- 抗原修复
- 免疫组织化学染色
- 复染(如果需要)
- 脱水并用封固剂封固
- 显微镜下观察染色
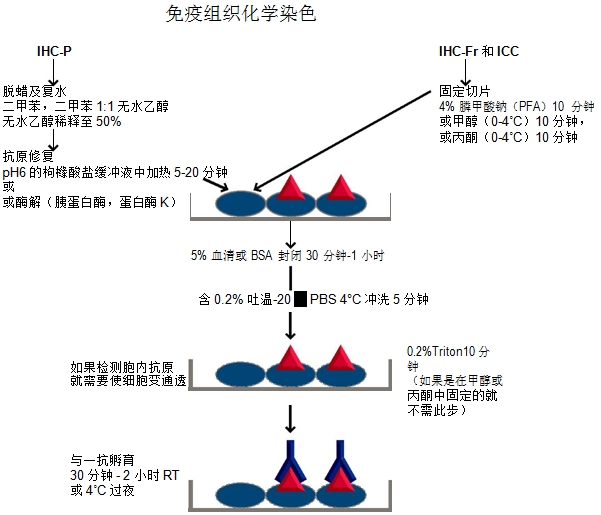
1、优化 IHC-P 新抗体
一种新抗体要应用到 IHC-P 中,就必须找到适宜这种抗体的染色条件。每种抗原都有一个最佳修复方法。每种抗体都有一个最佳稀释浓度。
抗原修复
试着在没有抗原修复和应用下列抗原修复方法修复抗原的情况下染色,详细操作见抗原修复部分(第 30 页)。
热修复:枸橼酸钠 10 mM,pH 6.0
热修复:Tris/EDTA pH 9.0
酶解:胰蛋白酶、胃蛋白酶或其它蛋白酶。
抗原修复的最佳方法确定后,就可以进行最佳抗体浓度的确定了。
一抗浓度
如果抗体浓度未知,我们建议用 0.5 μg/ml 和 5 μg/ml 4°C 过夜。如果抗体未经纯化,我们建议开始时使用下面的初始稀释度,也可以尝试 20 倍的高倍稀释度。
全抗血清:1/50
腹腔积液:1/100
组织培养上清:不稀释(也指“neat”)
检测
我们建议使用辣根过氧化物酶 (HRP),在光学显微镜下观察。过氧化物/DAB 作为底物和色素原。荧光显微镜方法中有多种荧光染料标记的 抗体,具体用哪一种要根据试验需要来进行选择。
2、固定
正确的固定是免疫组织化学方法的关键。最常用的是 10% 中性甲醛溶液 (NBF)。Abcam 说明书推荐 IHC-P 使用该固定剂,除非另有说明。 其它不常用的固定剂如多聚甲醛 (PFA) 或 Bouin's 液(甲醛/苦味酸)等。
理想的固定时间取决于组织块的大小和类型。对于大多数组织来说,通常固定时间在 18-24 小时之间较为理想。固定不足会导致组织切片因 边缘染色而信号强,中间未染上而无信号。固定过度将会屏蔽抗原表位。抗原修复有助于克服屏蔽作用,但是如果固定时间太长(比如一个 星期)那么抗原修复也无济于事。
固定后,将组织块包埋于石蜡中,用切片机切成理想厚度(依据组织一般大约在 5-20 微米),然后将切片附着在玻片上,封固最好用正电荷吸 附或 3-氨基-丙酯-三-乙氧基-硅烷 (APES),室温过夜脱水并彻底干燥。如果切片不能很好的附着在玻片上,可以将其至于 60°C 放置数小时。
3、脱蜡
在开始染色之前,切片必须先脱蜡至水。脱蜡不彻底,就会使切片很难染上色。
材料及试剂
二甲苯
无水乙醇
95% 乙醇
方法
- 将切片置于架子上,依据下列方法冲洗:
- 二甲苯:2 X 3 分钟
- 二甲苯与无水乙醇 1:1 混匀:3 分钟
- 无水乙醇:2 X 3 分钟
- 95% 乙醇:3 分钟
- 70 %乙醇:3 分钟
- 50 % 乙醇::3 分钟
- 冷的自来水小水流冲洗
在开始抗原修复前确保切片一直浸没在水中以防变干,否则特异抗体不易结合且会有很高的染色背景。
4、抗原修复
大多数甲醛固定的组织在开始染色之前都需要先修复抗原,这是由于在固定过程中产生了亚甲基桥使蛋白之间交联屏蔽了抗原位点。
两种抗 原修复方法为热修复法(称之为热诱导抗原表位修复或 HIER)和酶解法。
这些修复方法原理都是将亚甲基桥打断,使抗原表位暴露出来,以便于抗体结合。有的抗原适合酶解修复,有的抗原适合热修复。酶解修复 有时会损坏组织的形态结构,因此需要摸索酶浓度和作用时间。Tris/EDTA pH 9.0 的缓冲液适合于大多数抗原,pH 6.0 的枸橼酸钠缓冲液也 较为常用。以下网站解释了为什么 Abcam 建议首选 Tris/EDTA pH 9.0 的缓冲液而不是 pH 6.0 的枸橼酸钠缓冲液。
热抗原修复需要高压锅、微波炉或蒸煮锅。另外,一些实验室将玻片置于修复溶液中 60°C 水浴过夜。除非抗原修复方法在抗体数据表中可 以找到,否则必须通过实验来确定适宜的修复。Abcam建议尝试多种方法来确定适宜的修复方法,以便于获得理想的染色。
热修复缓冲溶液
下面是三种HIER较为常用的缓冲溶液,对于一个特定的抗体,在没有其他研究者建议的情况下,要通过实验确定选用哪种修复缓冲液。
枸橼酸钠缓冲液 (10 mM Sodium Citrate, 0.05% 吐温- 20, pH 6.0)
1 mM EDTA, 调至 pH 8.0
Tris/EDTA 缓冲液 (10mM Tris, 1 mM EDTA 溶液, 0.05% 吐温-20, pH 9.0)
热修复法
a) 高压蒸汽法
玻片要置于金属架上
材料及试剂
家用不锈钢高压锅
加热板
玻片架放置容器(容量大约 400-500ml)
抗原修复缓冲液(如 Tris/EDTA pH 9.0,枸橼酸钠 pH 6.0)
方法
- 将合适的抗原修复缓冲液加入高压锅内,然后将锅置于加热板并开至最大功率,此时不要把盖子盖紧。在等待煮沸过程中,按前面描述进 行脱蜡至水。
- 煮沸后,将玻片从自来水中取出放入高压锅内。小心热溶液 - 使用镊子。依照说明书加上加压阀。
- 高压锅达到最大压力后(见操作手册),维持 3 分钟(见注意事项 1)。
- 3 分钟过后,关掉加热板,将高压锅取下放置。
- 打开高压锅阀门(见操作手册),冷水冷却锅身。压力降下后,打开锅盖,冷水冷却 10 分钟。
注意事项:
![]()
![]() 3 分钟只是抗原修复的建议时间。低于 3 分钟可能会使修复不彻底,导致染色较弱。而超过 3 分钟可能会使修复过度,导致非特异性背景 染色,同时增加切片离解的几率。因此需要做对照试验,同样的组织切片分别修复 1、2、3、4、5 分钟后开始染色,针对所用的特异抗 体选择最佳修复时间。
3 分钟只是抗原修复的建议时间。低于 3 分钟可能会使修复不彻底,导致染色较弱。而超过 3 分钟可能会使修复过度,导致非特异性背景 染色,同时增加切片离解的几率。因此需要做对照试验,同样的组织切片分别修复 1、2、3、4、5 分钟后开始染色,针对所用的特异抗 体选择最佳修复时间。
确保玻片彻底冷却可以便于下一步操作,而且使抗原表位在经历高温后复原。
b) 微波法
不建议使用家用微波炉。因为它会导致抗原修复时冷热不均。而且由于没有高压环境,修复时间较长,会使切片解离。建议使用科研专用微 波炉较为合适。大多品牌的科研专用微波炉都有加压装置,能持续保持 98°C 从而避免切片解离。唯一的缺陷就是它的价格昂贵。
使用该方法时,修复缓冲液煮沸会大量蒸发,要确保缓冲液的量,不能使切片变干。
材料和试剂
家用 (850W) 或科研专用微波炉
微波炉专用玻片放置架及容器(容量大约 400-500ml)或染色缸
抗原修复缓冲液(如 Tris/EDTA pH 9.0,枸橼酸钠溶液 pH 6.0,等等)
方法
- 按前面描述将切片脱蜡至水。
- 向微波炉专用容器中加入合适的修复缓冲液(见注意事项 1)
- 从自来水中取出切片并放入容器中,置于微波炉内。如果用家用微波炉,就将之开到最大功率至开始沸腾并煮沸 20 分钟。如果采用科研 专用微波炉,就将温度设置在 98°C 维持 20 分钟以修复抗原(见注意事项 2)。
- 20 分钟后,取出容器放置水中冷却 10 分钟。小心热溶液(见注意事项 3)。
注意事项:
使用非密封的容器,要确保修复缓冲液足以浸没切片几厘米,防止在煮沸过程中切片变干。
20 分钟只是抗原修复的建议时间。低于 20 分钟可能会使修复不彻底,导致染色较弱。而超过 20 分钟可能会使修复过度,导致非特异性 的背景染色,同时会增加组织切片从玻片上解离的几率。因此需要做对照试验,同样的组织切片分别修复5、10、15、20、25、30 分钟 后开始染色,针对特异抗体选择最佳修复时间。
确保玻片彻底冷却可以便于下一部操作,而且使抗原表位在经历高温后复原。
c) 蒸煮锅法
许多实验室使用蒸煮锅或电饭煲加热。此方法与微波法相似,都是将缓冲液温度维持在 100°C,不同之处在于沸腾时此方法没有微波法反应 激烈。该方法也可用 100°C 水浴代替。
材料和试剂
蒸煮锅
玻片放置架及容器(容量大约 400-500ml,如果采用 Tissue –Tek 容器大约 250ml)
抗原修复缓冲液(如 Tris/EDTA pH 9.0,枸橼酸钠溶液 pH 6.0,等等)
方法
- 按前面描述将切片脱蜡至水。
- 依据用户手册设置蒸煮锅并预热。
- 在烧瓶中加热适量修复缓冲液并煮沸(用微波炉加热会更方便)。
- 将盛放玻片架的容器放置蒸煮锅中。
- 将热修复缓冲液小心加到容器中,然后放入玻片架。也可以采用更简捷的操作,先向容器中加热修复缓冲液再放入蒸煮锅中。
- 加盖。盛放缓冲液的容器也须配备盖子。刚开始时玻片架可能会使修复溶液温度降低,但几分钟内会回升到 95-100°C 之间。
- 达到温度后维持 20 分钟。
- 20 分钟后,取出容器放置水中冷却 10 分钟。热溶液使用注意事项(见微波法注意事项 2)。
d) 酶解抗原修复法
依据抗体数据表中选择需要的酶。如果没有,那么胰蛋白酶适用于大多数福尔马林/PFA 固定后需要修复的抗原。
至少有两种将酶溶液加到组织上的方法:直接用吸管将酶溶液滴加到玻片的组织上或将组织玻片放入酶溶液中。第一种方法反应试剂需要量 少,但是因为每个玻片需要分别处理,较不容易保证孵育时间的一致。鉴于此,在处理大批量玻片(如数量>5)时,采用第二种方法较容易。 如果采用全自动染色系统(如 Ventana),要查阅酶解修复操作指南。
材料和试剂
• 37°C 孵育箱
• 加湿器(恒温箱自带或在容器内放入湿纸巾)
• 两个盛 TBS 的玻片架容器(TBS 配方详见缓冲液部分第 71 页)
• 酶解抗原修复溶液(胰蛋白酶如下所述,胃蛋白酶和蛋白酶K见缓冲液部分第71页)
下面介绍一下胰蛋白酶法。有市售已优化的 IHC 用胰蛋白酶产品(Abcam,货号 ID ab970).
方法
- 将胰蛋白酶预热至 37°C。小心的将组织切片周围的水吸干,然后吸取酶溶液滴加到切片上(一般 50-100μl 即可)。用吸管尖端将酶溶液 铺盖住整个切片,注意不要弄坏组织。
- 将玻片置于加湿器内,然后 37°C 孵育。避免直接将玻片放入恒温箱架子上,否则会因温度不均影响染色质量。盛放玻片的容器最好先预 热再放入恒温箱内。
- 10-20 分钟(需要优化)后,取出玻片,流水冲洗 3 分钟。
e) 浸泡法
材料和试剂
37°C 水浴
玻片架及玻片架容器
酶解抗原修复溶液(胰蛋白酶见滴加作用液法,胃蛋白酶和蛋白酶 K 见缓冲液部分第 71 页)
方法
- 将水浴温度设置为酶最适宜的温度。向盛放玻片架的两个容器中加入超纯水。容器放入水浴中加热。
- 按上述方法将切片脱蜡至水后放入水浴箱其中一个容器中加热。
- 用水浴箱中另一个容器中的热水制备酶解抗原修复缓冲液,然后将盛有缓冲液的容器放回水浴箱中重新加热。
- 将加热过的玻片放入酶溶液中 10-20 分钟并间歇缓慢震荡。取出玻片在流水下冲洗3分钟,将酶漂洗干净。
注意事项:
仔细阅读酶使用手册,因为有些酶需要特殊的缓冲溶液和活性辅助因子。
水或缓冲液的体积要足够没过玻片。
若将冷玻片直接放入酶溶液中会使溶液温度降低从而酶活性降低,导致抗原位点修复不彻底。
尽可能快的准备出抗原修复缓冲液以避免妨碍酶活性的发挥。放入玻片之前使溶液达到需要的温度。
10-20 分钟只是孵育的建议时间。低于 10 分钟可能会使修复不彻底,导致染色较弱。而超过 20 分钟可能会使修复过度,导非特异性背 景染色,增加切片从玻片上解离的几率,损坏组织形态。因此需要先做对照试验,同样的组织切片分别孵育 10、15、20、25、30 分钟后 开始染色,针对特异抗体寻找到最佳修复时间。
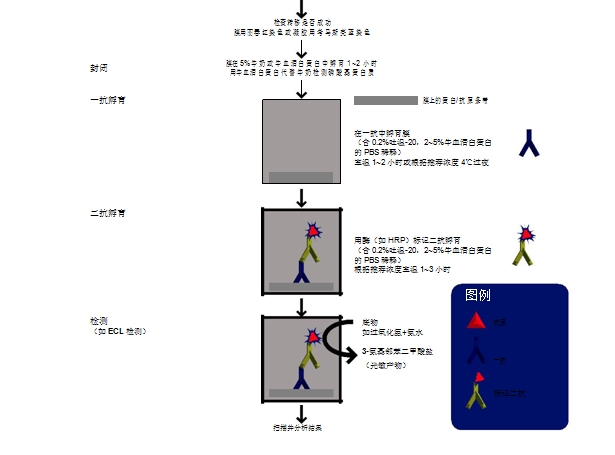
5、免疫组织化学染色和检测实验方案
5.1 一般原则
![]() 下面的操作适用于没有全自动染色机或 capillary gap system 等的实验室(如Shandon
Sequenza)。可用吸管人工加试剂,该手册也适用于 全自动或半自动系统。
下面的操作适用于没有全自动染色机或 capillary gap system 等的实验室(如Shandon
Sequenza)。可用吸管人工加试剂,该手册也适用于 全自动或半自动系统。
培养箱应配备有加湿器避免组织变干。变干发生在任何阶段最后都会导致非特异性染色及高背景染色。带密封盖的浅塑料盒,底部铺上湿纸 巾就是一个加湿装置。玻片只要不贴聚纸巾且平放就不会变干,一个好的解决办法就是,将一根塑料输液管切割成若干适合恒温箱的小段, 用胶两个两个的粘到恒温箱底部,每对管之间间隔 4cm,这样能给玻片一个平稳及升起的小平台,使玻片直接接触湿纸巾。
一抗和二抗的最佳稀释度可以从数据表中找到,或者通过试验获得。根据所获得的结果调节至最佳稀释度。要严格遵照说明书中的孵育时间。
酶解法中,辣根过氧化物酶 (HRP) 和碱性磷酸酶 (AP) 是最为常用的酶。这些酶有许多底物。
5.2 操作步骤
- 第一天
如使用 HRP 标记二抗检测,则需要封闭掉内源性过氧化物酶,但我们建议在开始一抗孵育前不予理会。
在含 0.025% Triton X-100 的 TBS 漂洗玻片 2 X 5 分钟,轻轻震荡。
用含 10% 正常血清、1% BSA 的 TBS 室温封闭 2 小时。空干封闭液(不是漂洗),并用纸巾将玻片周围擦干。
一抗用含 1% BSA 的 TBS 稀释后加到玻片上。
4°C 孵育过夜。
- 第二天
用含 0.025% Triton X-100 的 TBS 漂洗 2 X 5 分钟,并轻轻震荡。
如使用 HRP 标记二抗检测,则需将玻片在含 0.3% H2O2 的 TBS 中孵育 15 分钟 以封闭内源性过氧化物酶。
酶法检测(HRP 或 AP 标记二抗):
参照厂家推荐的稀释度,用含 1% BSA 的 TBS 稀释酶标二抗,加到玻片上后室温孵育 1 小时。
- 荧光检测:
![]() 参照厂家推荐的稀释度,用含 1% BSA 的 TBS 稀释荧光标记的二抗,加到玻片上后室温孵育 1 小时。
参照厂家推荐的稀释度,用含 1% BSA 的 TBS 稀释荧光标记的二抗,加到玻片上后室温孵育 1 小时。
在 TBS 中漂洗 3 X 5 分钟。
如采用荧光检测,则结束此步后就可以用封固剂和盖玻片进行封固了。如采用底物显色,则还需继续进行下述操作。
室温下与底物作用 10 分钟。
流水冲洗 5 分钟。
复染(如果需要)。
8脱水,擦干并封固。
5.3 对照
为了评价非特异性交叉反应和 Fc 受体结合的影响,与一抗同型但不相关的抗体(如 BrdU)将来用做对照。与不相关抗原结合的抗体称为同 型对照。对于全血清抗体而言,对照抗体是来源于同种动物的未免疫正常血清。
如果没有同型对照,阴性对照也可,就是用抗体稀释液代替一抗。强力推荐阳性组织对照,确保抗体达到预期效果。根据实验需要,也可设 阴性组织对照,在该组织中应没有目标蛋白存在的。
注意事项:
![]()
![]()
- 二抗可能会与组织内的内源性免疫球蛋白发生交叉反应。以二抗同种动物来源的正常血清预处理组织,可减少这种作用。加一抗前先与正 常血清孵育从而消除 Fc 受体与一抗和二抗结合。抗体稀释缓冲液中的 BSA 能降低疏水作用引起的非特异结合。
如果组织样品经醛类如甲醛、多聚甲醛、戊二醛等固定后用免疫荧光法 (IF) 检测,在加一抗之前要用含 0.3M 甘氨酸的封闭液封闭。因为甘 氨酸能结合自由醛基,否则这些醛基会与一抗和二抗结合造成高背景染色。使用多聚甲醛或戊二醛固定时,由自由醛基导致的高背景很有 可能发生。
- 一抗应稀释到厂家推荐的最佳稀释度或者曾经筛选到的最佳稀释度。如果没有起始稀释倍数,我们建议按下述操作。大多数 IHC-P 用抗体 的使用浓度在 0.5-10μg/ml 之间。要确保一抗和被染色的组织来自不同物种。例如,小鼠组织,一抗来自小鼠,抗鼠 IgG 二抗会与小鼠组 织中的所有内源性 IgG 结合,导致高背景染色。将小鼠单克隆抗体用于小鼠组织将在我们小鼠-对-小鼠部分中讨论。
- 过夜孵育可以使低亲和力的抗体有较长的时间结合到抗原上。然而,不管抗体亲和力的高低,一旦抗原抗体结合达到饱和或平衡,就不会 再发生结合。因此,过夜孵育确保了结合达到平衡。
- 过氧化氢 (H2O2) 能抑制内源性过氧化物酶活性从而降低背景染色。检测是否存在内源性过氧化物酶,在 DAB (3,3’二氨基邻苯胺底物)溶液 中水解后孵育组织玻片。如果切片在显微镜下出现棕色区域,说明存在过氧化物酶,因此应该做封闭。一些表位被过氧化物修饰了,降低 了抗原抗体的结合。初步孵育后再将切片与过氧化物孵育就能避免此问题。
- TBS 或水稀释过氧化氢。有些实验室用甲醇稀释,甲醇更适合于血涂片或其它富含过氧化物酶的组织如肝脏。甲醇稀释过氧化氢可减 少水溶液对组织的损坏。对于其它组织,我们建议使用 TBS 或水。甲醇/过氧化物孵育后会降低一些抗原抗体的结合,特别是
- 对于细胞表 面蛋白来说。
- 内源性过氧化物酶的封闭只用于过氧化物酶标记物如 HRP。
- 酶联底物产生有色沉着。最终产生什么样的有色沉着取决于用什么酶标签以及采用水溶性封片剂还是有机溶剂封片剂。
- 观察组织和细胞形态的复染剂通常是苏木精(蓝色)、核固红或甲基绿。采用荧光检测法时,复染用 DAPI(蓝色)或碘化吡/ PI(红色)
- 切记 DAB 是一种致癌物,操作时要穿上防护服。与次氯酸钠在密封容器中过夜可弱化它的致癌作用(相互作用产生有害气体),再根据 实验室操作规程处理。如果使用 AP,取 0.24mg/ml 的左旋四咪唑加到染料溶液中,来抑制内源性磷酸酶的活性从而降低背景染色。
- 如果使用AEC、固红、INT 或其它水溶性染料,切记它们溶于醇类溶剂中。要选用合适的水溶性封片剂。切勿进行下述步骤中的脱水擦干。
- 通过再水化使切片脱水并擦干其上的 DAB、新品红、NBT、TVega 红、NBT 或其它有机染料。按照再水化操作步骤的反向操作。
- 将玻片置于 50% 乙醇中 3 分钟。
- 70% 乙醇 3 分钟。
- 95% 乙醇 3 分钟。
- 100% 乙醇 3 分钟。
- 二甲苯与无水乙醇 1:1 混合液 3 分钟。
- 二甲苯 2 X 3 分钟。
-在适当的有机封固液中封固切片。在有机封固液中封固切片比在水溶性封固液中封固得到的折射率更好。在显微镜下看到的图像更清晰明显。
5.4 信号放大
亲和素—生物素(ABC)
该技术是由 Su-Ming Hsu 及其同事 (J Histochem Cytochem. 1981 Apr 29 (4):577-80) 共同建立的。亲和素是在鸡蛋白中发现的,亲和力高 ,有4个不可逆的生物素结合位点,并且这种结合是不可逆的。生物素是羧基化反应中酶的辅助因子。
简言之,先将一抗结合到靶蛋白上,再将生物素标记二抗结合到一抗上。另一反应系统中,将亲和素与生物素化的酶按一定比例混合形成亲和素—生物素—酶复合物,使亲和素上保留一定的未结合位点。切片与抗体孵育后再与此复合物共同孵育,使复合物亲和素上未结合位点与 生物素化的二抗结合,相比较酶标二抗或一抗而言可以使更多的酶接触到底物。
亲和素—生物素复合物有市售的试剂盒,提供有两种试剂及结合最佳比例的操作说明。该复合物适用于 Abcam 的任何生物素化的抗体。如果组织中存在有内源性的生物素,如肾脏、肝脏、大脑、前列腺、结肠、肠、睾丸等会与亲和素—生物素复合物结合导致背景染色 (Wang and Pevsner, Cell Tissue Res. 1999 Jun;296(3):511-6.)。Abcam提供有抑制这种结合的试剂盒,产品编号是 ab3387。
标记的链霉生物素 (LSAB)
该方法同 ABC 法相似,它利用了链霉亲和素(亲和力与卵白素相似)和生物素之间的相互作用。一抗与生物素标记的抗 Ig 二抗结合后,再 与结合在酶或荧光染料上的链霉亲和素结合。Abcam 提供有链霉亲和素 — HRP 结合物,产品编号是 ab7403。
应用链霉亲和素代替生物素可以减少非特异性背景染色,因为链霉亲和素是非糖基化的,(卵白素不是),因此它不会与凝集素或其它糖结 合蛋白反应。而且 LSAB 法比 ABC 法灵敏 4—8 倍(详见 Giorno R, Diagno Immunol. 1984;2(3):161-6)。
HRP 聚合物
将二抗与聚合物-酶复合物结合形成的新型聚合物-酶-抗体产物(如抗鼠和/或兔 IgG)优于卵白素—生物素 (ABC) 和标记的链霉生物素 (LSAB)。 因为此种方法比上述两种方法减少一步,从而免除了内源性生物素的干扰。Abcam 提供有羊抗兔/鼠 IgG HRP 多聚物,产品编号是 ab2891。
直接酪胺信号放大法 (T![]()
![]() SE)
SE)
![]()
![]()
![]() 信号扩大最有效的方法之一是 TSE,受专利保护(又称 TSA 或 CSA,不同厂家的试剂盒标示不一样),特别适用于其它检测系统难以检测
到的相对稀少的抗原,并且可以增强结合力弱的抗体的反应结果。
信号扩大最有效的方法之一是 TSE,受专利保护(又称 TSA 或 CSA,不同厂家的试剂盒标示不一样),特别适用于其它检测系统难以检测
到的相对稀少的抗原,并且可以增强结合力弱的抗体的反应结果。
此方法是一抗和 HRP 标记二抗结合后利用过氧化物酶的催化作用,使酪胺蛋白中酪胺部分与抗体共价结合。即使在处理玻片清洗抗体时, 共价结合的蛋白也不会被洗掉,因为酪胺键是共价的。将酶或荧光染料标记抗体直接结合到酪胺蛋白结合物的蛋白部分,就可以获得信号。 市售的试剂盒中蛋白是生物素,应用的是链霉亲和素标记酶而不是抗体结合物。此方法的缺点是试剂盒昂贵,且步骤多时间长。
二、免疫组织化学 (IHC-Fr)-冷冻切片切割技术
冷冻切片:切片经 3-氨基-丙酯-三-乙氧基-硅烷(APES)包被玻片封固后,最好在 -80°C下保存,需要时再取出。
- 需要时取出后室温恢复 5 分钟。
- -20°C 预冷固定剂(丙酮、甲醇或乙醇)30 分钟。(Abcam 首推丙酮)
- 冷固定剂室温固定 5-10 分钟。
- PBS 漂洗 3×4 分钟。
非醛类固定时不需进行抗原修复步骤。但是如果冷冻组织或细胞经福尔马林固定,就需要进行抗原修复。但易碎的样本,如大脑组织或会影 响结果。下面的参考文献介绍了将切片放置在玻片上之前怎样用 3-氨基-丙酯-三-乙氧基-硅烷 (APES) 处理玻片。这种处理方法能提高粘附力, 使抗原热修复对组织形态的损害降到最低:
三、免疫细胞化学 (ICC) 指南
1、一般步骤
- 加盖玻片,聚氮丙啶或多聚左旋赖氨酸室温作用 1 小时。
- 灭菌水漂洗盖玻片 3×5 分钟。
- 盖玻片彻底干燥后,紫外灯灭菌至少 4 小时。
- 玻璃盖玻片上种上细胞,或制作细胞样本或涂片标本。
- 磷酸盐缓冲液(PBS)漂洗。
固定
- 冷甲醇、丙酮固定样品 1-10 分钟,或含 3-4% 多聚甲醛 pH 7.4 的 PBS 室温固定 15 分钟。
- 冷PBS冲洗样品2次。
通透
- 如果靶蛋白是细胞内表达的,那么使细胞膜变通透就很重要了。注:丙酮固定的样品不需要通透。
- 将样品在含 0.25% Triton X-100(或 100μM 洋地黄皂苷或 0.5% 皂角苷)的 PBS 中孵育 10 分钟。Triton X-100 是最常用的去污剂,能增 强抗体的穿透力。因为它对细胞膜有损坏作用,因此不适用于与细胞膜结合的抗原。
- PBS 冲洗细胞 3×5 分钟。
封闭及孵育
- 细胞在含1%BSA的PBST(封闭液也可以选择含1%明胶或10% 与二抗同种动物来源的血清)中孵育30分钟,以阻断抗体的非特异性结合。
- 细胞与抗体(含 1% BSA 的 PBST 稀释)在湿盒中共同孵育,室温 1 小时,或 4°C 过夜。
- 弃去液体,用 PBS 冲洗细胞 3×5 分钟。
- 细胞与二抗在 1% BSA 中孵育,室温 1 小时,避光。
- 弃去二抗溶液,并用 PBS 冲洗细胞 3×5 分钟,避光。
复染
- 在 0.1-1μg/ml Hoechst 或 DAPI(DNA 染色剂)中孵育细胞 1 分钟。
- PBS 冲洗。
封固
- 向盖玻片上滴加一滴封固液封固。-
- 用指甲油密封盖玻片防止变干并移至显微镜下观察。
- -20°C 或 +4°C 避光保存。
四、IHC/ICC 中的固定和通透技术
1、固定:
![]()
![]() 固定就是保持抗原细胞和亚细胞结构固定不动,同时又能使抗体进入到细胞和亚细胞的所有部位。固定和通透方法的选择取决于抗原表位和
抗体本身的灵敏性,有时需要优化。
固定就是保持抗原细胞和亚细胞结构固定不动,同时又能使抗体进入到细胞和亚细胞的所有部位。固定和通透方法的选择取决于抗原表位和
抗体本身的灵敏性,有时需要优化。
固定时可使用一些交联试剂,如多聚甲醛,有利于保护细胞结构,但是可能会降低一些细胞成分的抗原性,因为交联阻碍了抗体结合。鉴于 此,可采用抗原修复技术,尤其是固定孵育时间较长时或使用高百分比的交联度固定剂时。另外一种选择就是使用有机溶剂,但是它们会吸 去脂类使细胞脱水,同时会使蛋白沉淀在细胞架上。
4% 多聚甲醛
- 向玻片滴加 4% 多聚甲醛,维持 10 分钟。
- PBS 或含 1%BSA 的 PBS 冲洗细胞。
乙醇
- 向玻片滴加 100-200μl 预冷的 95% 乙醇,5% 冰醋酸,维持 5-10 分钟。
- PBS 或含 1%BSA 的 PBS 冲洗细胞。
甲醇
- 向玻片滴加 100-200μl 的冷甲醇。 -20°C 维持 10 分钟。
- PBS 或含 1%BSA 的 PBS 冲洗细胞。
丙酮
- 向玻片滴加 100-200 μl 的冷丙酮。 -20°C 维持 5-10 分钟。
- PBS 或含 1%BSA 的 PBS 冲洗细胞。
2、通透:
![]()
![]()
通透技术仅用于抗体需进入细胞内检测蛋白时,包括细胞内蛋白和抗原表位位于胞内区的跨膜蛋白检测。
溶剂:
![]()
![]()
- 丙酮固定也有通透作用。
- 甲醇固定也可通透,但不是总适用。
- 这些反应试剂都可用来固定和通透,也可在交联剂如多聚甲醛固定后再使用。
去污剂:
- Triton 或 NP-40
0.1-0.2% Triton 或 NP-40 的 PBS 洗涤 10 分钟。
这些去污剂同样也能溶解部分核膜,因此非常适合于核抗原染色。
- 吐温-20,皂角苷,洋地黄皂苷和 Leucoperm。
用0.2-0.5% 洗涤 10-30 分钟。
这些是较温和的细胞膜溶剂。它们会使细胞膜产生足够大的孔,促使抗体进入细胞内而不用溶解胞膜。适合于胞浆内抗原质膜的胞浆表面抗 原和可溶的核抗原。
特别建议:
![]()
![]() - 用丙酮、乙醇或甲醛(高浓度)固定细胞骨架、病毒和一些酶抗原,可获得理想的结果。
- 用丙酮、乙醇或甲醛(高浓度)固定细胞骨架、病毒和一些酶抗原,可获得理想的结果。
- 位于细胞器和胞浆颗粒上的抗原,其固定和通透方法的选择取决于抗原本身,需尽量保留表位。
五、灌注固定法
出于多种考虑,将小组织片段简单浸泡在固定液中便能得到合适的固定,对大多数组织来说可能是唯一的固定模式。然而更快、更均一的固 定方法是将固定液通过管道系统如心主动脉或腹部主动脉灌注到组织中。下面介绍一下用 4% 多聚甲醛固定大鼠大多数器官的操作步骤。
1、材料
麻醉剂
手术用剪刀、镊子、止血钳
锯齿小镊子
手术刀
放置样品的带塞子的小瓶 (5-10ml)
0.9% 生理盐水
500ml 烧杯
4% 多聚甲醛、固定液
手套、防护眼镜
蠕动泵(或将烧瓶固定在距手术台上方 150cm 处,口向下)
心主动脉灌注用输液针,长 50mm,外径 1.3-1.5mm
带有静脉输血用的滴注腔的灌注装置
2、心脏灌注固定法
- 设置蠕动泵,安装灌注装置和输液针。首先,取 100ml 水冲洗管道除去管内残留物,然后烧杯盛满 4% 冷多聚甲醛(冰盒预冷),将灌注 管末端置入烧杯中。溶液体积应该与动物大小成比例,通常对于一只动物来说 100-200ml 足够。打开阀门,调节到一个缓慢而稳定的速度 (20ml/min),然后关闭阀门。
- 在操作台上将剪刀、镊子和止血钳放在适宜操作的位置。给动物注射合适剂量的麻醉剂。动物一旦处于麻醉状态后,将其背部向下放在操 作台上。可以使用带子固定确保动物不动。
- 用捏反应法检测麻醉程度。在开始下述操作之前确保动物是无反应的。
- 在腹部用手术刀沿着膈肌切一个口,用锋利的剪刀剪开膈肌底部连着的组织,确保能进入胸腔。
- 取大号剪刀,钝端向下,切穿左胸肋廓。
- 横向切穿肋骨一到两厘米,打开胸腔。用止血钳打开,使心脏暴露出来。准备排血和输液装置。
- 用镊子固定住心脏(心脏应该还在跳动),在左心室跳动部位直接插入针头,垂直外露 5mm。注意针头不要插入太多,以防刺破心室壁 影响溶液循环!用止血钳将针头固定在输入口。打开阀门使 0.9% 的生理盐水以缓慢、稳定的流速大约 20ml/min 输入动物体内。
- 用剪刀在心房处剪一个口,保证溶液自由流动。如果溶液不能自由流出或溶液从动物的鼻孔或口腔流出,则要让针头复位。
- 当血液快排干时,换上 4% 多聚甲醛溶液(200-300ml)。
- 当肝脏自发跳动(福尔马林“跳舞”)及颜色变浅时表明灌注完成。(注:一般地,一只成年大鼠的灌注时间大约是 30-60 分钟,但是根据 动物大小和技术的不同也有所差别)。
- 终止灌注,切除靶组织,放置盛有同种固定液的小瓶中,冰上或 4°C 固定 2 小时,再脱水包埋。4°C 浸泡过夜固定,效果更好。
3、腹主动脉灌注法
- 按上述方法准备材料和动物(步骤 1-3)。
- 在腹部正中横向剪开一个长切口,打开腹腔,将肠道轻轻推至腹腔左侧。
- 小心地将肾主动脉始端下方的主动脉露出。轻轻地将腹主动脉与覆盖其上的脂肪组织及其它粘联组织剥离开。
- 用小镊子将主动脉壁牢牢地固定在距远端 0.5-1.0cm 分叉处。然后将折针紧贴镊子插入主动脉腔的近心端。
- 快速连续操作以下步骤:
- 用小剪刀在下腔静脉剪开一个口。
- 灌注。
- 夹住膈肌下方肾主动脉始端上方的主动脉。
- 肾脏表面呈现颜色均一、变浅发白时表明灌注完成。灌注一只成年大鼠来说流速至少要控制在 60-100ml/min。灌注 3 分钟。终止灌注,切 除并清理靶组织,并将之放置到盛有同种固定液的小瓶中(见后面的固定步骤),冰上或 4°C 固定 2 小时。4°C 浸泡过夜固定,效果更好。
- 脱水包埋组织。
六、鼠对鼠染色注意事项
用鼠抗体对鼠组织染色是个复杂的过程,因为容易导致背景染色高,而且很难消除。 形成这种背景主要是由于组织染色时二抗与内源性的鼠 IgG,或 B 细胞、浆细胞及巨噬细胞上的 Fc 受体结合造成的。
Abcam 不能保证鼠单克隆抗体与鼠组织(除非说明书有显示)。然而,必需鼠对鼠染色时,应用一些窍门可能会有助于减少这些背景染色。
1、封闭内源性 IgG![]()
![]()
![]()
![]()
- 按常规制备组织切片。
- 在封闭步骤,用血清(与二抗同种动物来源)室温封闭 30 分钟。
- PBS-吐温-20 冲洗 3 X 2 分钟。
- 组织切片与未结合的抗鼠 IgG 的 AffiniPure Fab 片段(H+L)室温孵育 1 小时或 4°C 过夜。
- 建议封闭抗体浓度用 0.1 mg/ml,但是否是最佳浓度仍需终端用户来评估。
- 抗体染色。
2、封闭内源性Fc![]()
![]() 受体
受体
以单克隆二抗F(ab)段封闭内源性 Fc 受体,有市售试剂盒。
- 切片在含 1% Triton 的 PBS 中室温孵育 30 分钟,“清净”组织。
- TBS–吐温-20 作为冲洗缓冲液比 PBS-吐温-20 更能减少背景染色。
七、 IHC/ICC 疑难解答提示
1、无染色
- 一抗和二抗不匹配
使用针对一抗的二抗(如一抗来自兔,二抗为抗兔抗体)
- 没有足够的一抗与目标蛋白结合
使用低稀释度抗体。延长 4℃ 孵育时间(如过夜)。
- 抗体的天然结构(3D 形态)受损不适用于 IHC![]()
![]()
用天然(非变性的)WB法检测抗体,确保抗体没被损坏。
- 由于不当储存、稀释或反复冻融造成一抗/二抗试剂盒失效
做阳性对照确认一抗/二抗试剂盒的有效性。
- 靶组织中没有目标蛋白
参照抗体供应商的建议做阳性对照。
- 组织中没有足够的目标蛋白
应用信号放大操作。
- 没有避光保存二抗
避免将二抗处于光照下。
- 脱蜡不彻底
延长脱蜡时间,更换二甲苯。
- 固定步骤(使用福尔马林和多聚甲醛固定剂)修饰了抗体识别表位
抗原修复法暴露出抗原表位,缩短固定时间。
- 蛋白位于细胞核内(核蛋白),抗体不能穿透核膜
在封闭液和抗体稀释液中加入通透剂。
- PBS 缓冲液被细菌污染后破坏了靶蛋白的磷酸根
在抗体 PBS 储存液中加入 0.01% 叠氮化合物,或使用新鲜无菌的 PBS。
2、高背景
- 没有封闭非特异性结合或封闭不充分
延长封闭时间,并考虑改换封闭剂。Abcam 建议用 10% 正常血清封闭切片 1 小时或 1-5% BSA 封闭培养细胞 30 分钟。
- 一抗浓度过高
滴定法寻找到最佳抗体浓度,或在浓度较低抗体中延长孵育时间(最好是缓慢而准确地结合)。
- 孵育温度过高
4°C 孵育切片或细胞
- 二抗发生了非特异性结合(被损坏)
不加一抗,做二抗对照。
- 组织冲洗不彻底,有固定剂残留
所有步骤都要用 PBS 充分洗涤。
- 存在内源性过氧化物酶活性
用酶抑制剂如抑制碱性磷酸酶的盐酸左旋咪唑 (2mM),或抑制过氧化物酶的 H2O2 (0.3% v/v)。(详见IHC操作手册)。
- 固定过度(固定剂用福尔马林和多聚甲醛)导致抗体识别抗原位点被修饰改变抗原修复方法,缩短与抗原修复液的孵育时间。-- 信号过度放大(信号放大技术)
缩短信号放大孵育时间,稀释信号扩大试剂盒。
- 底物过量(酶检测法)
缩短底物孵育时间
- 染料与 PBS 在细胞/组织中相互作用(酶检测法)
用 Tris 缓冲液冲洗切片后,再与底物孵育。孵育后,Tris缓冲液再次冲洗细胞/切片。
- 通透作用破坏膜并除去了膜蛋白
去除缓冲液中的通透剂
3、非特异性染色
- 一抗/二抗浓度过高
降低抗体浓度和或缩短孵育周期。对比不表达目标蛋白细胞的信号强度。
- 存在内源性过氧化物酶活性
用酶抑制剂如抑制碱性磷酸酶的盐酸左旋咪唑 (2mM),或抑制过氧化物酶的 H2O2 (0.3% v/v)。(详见 IHC 操作手册)。
- 一抗与被染组织同源(如用鼠一抗测鼠组织),加二抗后,二抗会与同源的所有组织结合应用与组织非同源的一抗
- 切片/细胞变干
保持切片/细胞湿度,切勿变干。
声明:以上内容由Abcam公司提供。
| 序号 | 最新资讯 | 浏览次数 | 发布时间 |
| 1 | WB流程视频及常用Buffer的配方 | 1280 | 2017-12-16 |
| 2 | WB 实验方案大全 | 3127 | 2017-12-15 |
| 3 | 免疫沉淀实验方案大全 | 965 | 2017-12-14 |
| 4 | ELISA 实验方案大全 | 1217 | 2017-12-14 |
| 5 | 免疫组化实验方案 | 2031 | 2017-12-14 |