蛋白质印迹
免疫印迹是利用聚丙烯酰胺凝胶电泳来检测特定样品或提取物中某种特定蛋白的方法。聚丙烯酰胺凝胶紧贴着膜放置,常用的膜是硝酸纤维素或PVDF(聚偏乙烯氟化物),在电流的作用下蛋白质从凝胶迁移到膜上并且被固定。膜是凝胶蛋白质的复制品,然后可以与抗体结合后进行染色。

Oncotarget,2017,14;8(7):11600-11613.
下面的免疫印迹模式图包括样品准备、凝胶电泳、凝胶到膜的转移以及检测蛋白的免疫染色。根据使用的电泳和转移设备,实验方案需要优化,建议读者参照厂家的说明书。
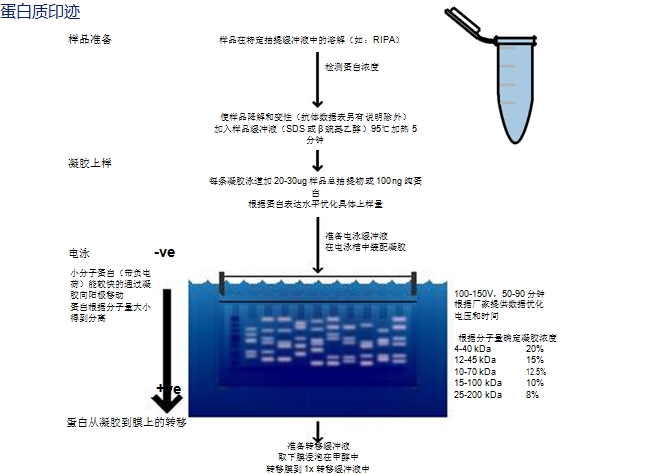
一、样品准备
1、裂解缓冲液
准备凝胶电泳的样品,需要对细胞和组织进行裂解以释放目的蛋白,这些可溶性蛋白能够穿过分离胶单独移动。裂解缓冲液有很多种,但用 来做 WB试验的仅有少数几种。简单来说,它们溶解蛋白的能力不同,含有十二烷基硫酸钠和其他离子型去污剂的溶解能力最强。
大部分 Abcam 抗体能够识别降解和变性蛋白质,因此应该在降解和变性条件下使用该类抗体。需要注意的是一些抗体仅仅识别天然的、非变 性蛋白质,故不能识别经去污剂(SDS、脱氧胆酸盐、弱降解作用的 Triton X-100 和 NP40)作用的蛋白质。
选择裂解缓冲液首先要考虑选择的抗体是否识别变性的样品。如果不能,有关资料会列在抗体说明书上,应该使用不含去污剂的缓冲液或者 是相对温和的非离子型缓冲液(NP-40,吐温 X-100)。
蛋白定位和裂解液的选择
|
样品类型 |
裂解液 |
|
全细胞 |
NP-40或RIPA |
|
细胞质(可溶性的) |
Tris-HCI |
|
细胞质(细胞骨架) |
Tris-Triton |
|
膜结合部分 |
NP-40或RIPA |
|
细胞核 |
RIPA或核裂解液 |
|
线粒体 |
RIPA或线粒体分离方案 |
*专门或主要表达在亚细胞结构区域的蛋白在亚细胞裂解物中比在全细胞和组织裂解物中更为富集。这对于提取弱表达蛋白非常重要。例如, 相对于全细胞或全组织裂解物来说,核表达蛋白在细胞核裂解物总蛋白中占有相当大的比例,这样凝胶条带中可以载入更多的目的蛋白。 另一个优点是排除了杂质成分潜在的交叉反应。请参考我们的亚细胞结构分离技术方案。
Nonidet – P40(NP40)缓冲液
这是研究细胞质蛋白、膜结合蛋白或者全细胞抽提物等常用的一种缓冲液。如果目标蛋白不能完全从不溶性或凝集物中提取, RIPA 缓冲液将 会更合适,它包含的离子型去污剂能更好溶解蛋白。
RIPA缓冲液(放射免疫沉淀分析缓冲液)
这种缓冲液对全细胞提取物和膜结合蛋白都非常有用,对提取细胞核蛋白来说,这种缓冲液比只含有 NP40 或 Triton X-100 的缓冲液更受欢 迎。但它会破坏蛋白与蛋白之间的相互作用,因此这在免疫沉淀测定中会有些问题。
在需要保存蛋白与蛋白相互作用,或者将蛋白变性降到最低(例如,抗体只能识别一个非变性表位)时,应该使用不含离子型去污剂(SDS)的缓冲液和不含非离子型去污剂(Triton X-100)的缓冲液。用不含去污剂的裂解液,一般需配合机械剪切来裂解细胞,常用的 Dounce 均浆器 或者将细胞反复通过注射器针头。这时简单的Tris缓冲液就足够了,但是对于膜结合蛋白或细胞骨架蛋白则需要含有去污剂的缓冲液。
2、蛋白酶和磷酸酶抑制剂
一旦裂解发生,水解、去磷酸化和变性就开始了。如果样本在冰上或始终在 4°C 存放以及一开始就往裂解液中加入适当抑制剂的话,这些反应将可以大大减缓。
混合(“鸡尾酒”)的蛋白酶和磷酸酶抑制剂已经商品化,也可以自己研制抑制剂的配比。
|
|
抑制剂 |
蛋白酶或磷酸酶 |
在裂解液中的终浓度 |
贮备液(保存在 -20°C) |
|
|
|
|
|
|
|
|
|
|
抑酶肽 |
胰岛素、胰凝乳蛋白酶、 |
2μg/ml |
水稀释至 10mg/ml |
|
|
|
|
血纤维蛋白溶酶 |
|
一旦融化不能再使用 |
|
|
|
|
|
|
|
|
|
|
亮肽酶素 |
溶酶体 |
5-10μg/ml |
水稀释,一旦融化不能再使用 |
|
|
|
|
|
|
|
|
|
|
抑肽素A |
天冬氨酸蛋白酶 |
1μg/ml |
甲醇稀释,1mM |
|
|
|
|
|
|
|
|
|
|
苯甲基磺酰氟化物(PMSF) |
丝氨酸半胱氨酸蛋白酶 |
1mM |
乙醇稀释,可重复使用 |
|
|
|
|
|
|
|
|
|
|
乙二胺四乙酸(EDTA) |
需要 Mg++ 和 Mn++ 的 |
5mM |
水稀释至 0.5M 调节 pH8.0 |
|
|
|
|
金属蛋白酶 |
|
|
|
|
|
|
|
|
|
|
|
|
乙二醇双(2-氨基乙醚) |
需要 Ca++ 的金属蛋白酶 |
1mM |
水稀释 0.5M 调节 pH 8.0 |
|
|
|
四乙酸(EGTA) |
|
|
|
|
|
|
|
|
|
|
|
|
|
氟化钠 |
丝氨酸/苏氨酸磷酸酶 |
5-10mM |
水稀释,一旦融化不能再使用 |
|
|
|
|
|
|
|
|
|
|
原钒酸钠 |
酪氨酸磷酸酶 |
1mM |
水稀释,一旦融化不能再使用 |
|
|
|
|
|
|
|
|
3、原钒酸盐准备
-所有步骤均在通风橱中进行。
-用双蒸水溶解原钒酸钠至 100mM。
-用盐酸调 pH 值至 9.0。
-加热至无色。为尽量减少由于蒸发所致体积减小,加热时加盖。
冷却至室温。
-调 pH 值至 9.0。
-再次加热至无色。
-再次加热冷却重复以上循环直至加热冷却后溶液 pH 值保持在 9.0。
-用水补至起始体积。
--20°C 分装保存,若变黄则废弃。
4、细胞培养裂解物的制备
-将细胞培养皿放置冰上并用冰冷的 PBS 洗涤细胞。
-吸干 PBS 后,再加入冰冷的裂解液(每 107 细胞 / 100mm2 培养皿/150cm2 培养瓶加 1ml,每5x106 细胞 / 60mm2 培养皿 / 75cm2 培养瓶 加 0.5ml)。
-用预冷的塑料细胞刮刀将贴壁细胞从培养皿上刮下,然后轻轻将细胞悬液转移到预冷的小离心管中。
-4°C 持续振荡 30 分钟。
-4°C 预冷微型离心机中 16,000 x g 离心 20 分钟。
-从离心机中轻轻地取出离心管放置在冰上。将上清液吸出转移到预冷的新管(放在冰上)中,弃沉淀。
5、组织裂解物的制备
-用干净器械解剖所需的组织,最好在冰上,并快速操作以防止蛋白酶降解。
-将组织放入圆底离心管或 Eppendorf 管中,浸入液氮中“速冻”。样本在 -80°C 储存备以后使用或放在冰上立即匀浆。
-对于约 5mg 组织,向管中迅速加入约 300μl 裂解液并用电动匀浆器均浆,裂解液冲洗刀片两次,每次 300μl,然后 4°C 持续振荡 2 小时(将 回旋振荡器放入冰箱)。裂解液的体积根据组织总量来决定。蛋白提取物不宜过于稀释,以避免蛋白质损失,并尽量减少样品体积以便凝 胶上样。最小浓度为 0.1mg/ml;最佳浓度为 1-5mg/ml。
-微型离心机 4℃ 16,000rpm 离心 20 分钟。从离心机中轻轻地取出离心管放置在冰上。吸出上清液放入预冷的新管(放在冰上)中,弃沉淀。
6、蛋白质浓度的测定
Bradford、Lowry 或 BCA 方法测定蛋白质含量,牛血清白蛋白是常用的蛋白标准。
一旦确定了每管的蛋白浓度就可以在 -20°C 或 -80°C 冷冻样品备用,或为免疫沉淀反应或凝胶上样做准备。
7、凝胶上样:变性的和天然的,还原的和非还原
变性还原蛋白
抗体特异性识别目标蛋白的部位(即抗原表位)可能存在于蛋白的三维构型内部。为了能使抗体接近抗原表位,必须将蛋白的三维构型打开, 即使蛋白变性。
要使蛋白质变性,使用含阴离子变性去污剂十二烷基硫酸钠 (SDS) 的上样缓冲液,95-100°C 煮沸 5 分钟,或者在 70°C 加热 5-10 分钟,尤 其是研究跨膜蛋白时,因为煮沸更易聚集,聚集物不能有效的进入胶中。
标准品上样缓冲液叫做2倍Laemmli缓冲液,最初描述在《自然》杂志上(1970 Aug 15;227(5259):680-5.)。也可以用4倍和6倍的样品缓冲 液,可以减少缓冲液对样品的稀释。2 倍的样品缓冲液和样品以 1:1 的比例混合。
使用 SDS,通过 SDS 阴离子的粘附作用,所有的蛋白质都带负电荷,SDS 通过“缠绕”多肽链使蛋白变性。SDS 以 1.4:1 的比例结合到蛋白 上,SDS 赋予多肽的负电荷数与蛋白的长度成比例,即变性的多肽成为负电荷云的“棒”,每一单位长度的多肽带有相同的电荷数或电荷云密度。
在变性 SDS-PAGE 中,迁移率不是由多肽固有的电荷数目来决定,而是由多肽的分子量来决定。SDS 的纯度尤为重要,蛋白质被染色的背 景与蛋白条带能显示出 SDS 质量的好坏。
通过加入β巯基乙醇或二硫苏糖醇(DTT),按照分子量大小进行分离,在蛋白形成自由弯曲之前减少二硫键的形成是非常必要的。
上样缓冲液中加入甘油能增加样品的密度,使样品停留在样品池的底部,防止外溢和使凝胶上样不规则。
为了能看到蛋白的迁移,通常在上样缓冲液中加入小分子的离子型染料(如溴酚蓝)。染料在混合物中的迁移速度最快,能够提供一个迁移 前沿来监测分离的过程。
蛋白质样品处理时,加热前后都要用漩涡振荡器彻底混匀样品,使溶解彻底。
天然的未降解样品
有些抗体识别的抗原表位在抗原的天然构型中由非临近氨基酸组成。虽然这些氨基酸在原始序列中是彼此分开的,但它们在蛋白的三维结构 中是相互靠近的。抗体只能辨认在折叠结构表面上的抗原。
在这样的情况下进行非变性条件 WB 是不可避免的,这一点会在产品的数据表上的应用部分提到。总之,非变性条件就意味着样品和电泳缓 冲液中不加入 SDS,以及不加热样品。
有些抗体仅仅识别非还原形式的蛋白质,如氧化形式(特别是半胱氨酸残基)的蛋白质。引起降解的试剂β巯基乙醇和 DTT 必须从上样缓冲 液和电泳缓冲液中除去。
|
蛋白状态 |
凝胶条件 |
上样缓冲液 |
电泳缓冲液 |
|
还原-变性 |
还原 & 不变性 |
β-巯基乙醇或DTT和SDS |
有 SDS |
|
|
|
|
|
|
还原-天然 |
还原 & 不变性 |
β-巯基乙醇或DTT无SDS |
无 SDS |
|
|
|
|
|
|
氧化-变性 |
非还原 & 变性 |
无β-巯基乙醇或DTT,有SDS |
有 SDS |
|
|
|
|
|
|
氧化-天然 |
非还原 & 天然 |
无β-巯基乙醇或DTT,无 SDS |
无 SDS |
|
|
|
|
|
二、电泳
电泳可以是单相的(即一维分离)也可以是双相的。单相电泳常用来进行蛋白和核酸的分离,蛋白的双相电泳用于指纹-识别(即总蛋白成分分析)和细胞里所有蛋白的精确定位。
这里我们所描述的是单相电泳技术。我们推荐《Gel Electrophoresis of Proteins: A Practical Approach》(第三版,B. D. Hames 和 D. Rickwood 主编,实用方法系列,牛津大学出版社,1998年)这本书作为理解双相电泳的参考。
1、PAGE 凝胶的制备
聚丙烯酰胺凝胶电泳,英文简称是 SDS-PAGE (Sodium Dodecyl Sulfate PolyAcrylamide Gel Electrophoresis),是根据蛋白质分子量来分离 蛋白质的基本方法。
聚丙烯酰胺凝胶由两种复合物混合而成,丙烯酰胺和 N,N-亚甲基丙烯酰胺(简称bis)。Bis 是凝胶的交联剂。通过加入过硫酸铵和 DMAP 或 TEMED 启动交联聚合作用。凝胶是中性,水溶性三维网状结构(通过亚甲基交联的碳氢化合物)。
凝胶对分子的分离取决于凝胶所形成的孔径大小。凝胶孔径的大小由两个因素决定:丙烯酰胺的总量(%T)和交联的数量(%C),当丙烯 酰胺的比例升高,孔径降低。5% C 时孔径最小。C% 增加或减少,孔径也随之增大或减少。凝胶以百分比进行设计,并且有二个重要的参 数。总丙烯酰胺指的是丙烯酰胺加上bis丙烯酰胺所占的百分比(w/v)。例如,7.5% T 表示 100ml 凝胶中有 7.5 g 丙烯酰胺和 bis。

凝胶可以商业购买或在实验室自己制备(配方可以在实验室手册上找到)。胶凝体的百分比对蛋白质迁移率和分离度至关重要。
拇指原则:目标蛋白分子量越小,mono/bis百分比越高;目标蛋白分子量越大,mono/bis的百分比越低。
|
蛋白大小(kDa) |
凝胶百分比(%) |
|
4-40 |
20 |
|
12-45 |
15 |
|
10-70 |
12.5 |
|
15-100 |
10 |
|
25-200 |
8 |
按照厂家说明将凝胶放在电泳槽中并且浸泡在电泳缓冲液中。
阳性对照
阳性对照裂解物用来表明试验是有效的并且是正确的,及可证明目标蛋白不在样本中表达。
当设定一个新实验时,我们强烈推荐使用阳性对照裂解物,这将提高试验的可信度。
分子量标准
跑在样品旁边的分子量标准能测定蛋白分子量的大小并且能监测电泳的进展。市面上有许多分子量标准可供选择。
Abcam有下列分子量标准:
货号 ab48854 (MW 70, 57, 40, 28, 18, 13.5 and 8.5 kDa)
货号 ab115832, Prism Protein Ladder (10-175 kDa)
货号 ab116027, Prism Ultra Protein Ladder (10-180 kDa)
货号 ab116028, Prism Ultra Protein Ladder (10-245 kDa)
货号 ab116029, Prism Ultra Protein Ladder (3.5-245 kDa)
2、上样和跑凝胶
使用特定的凝胶上样吸头或微型注射器在狭窄的样品池中加入全部样品,注意不要用尖头刺破池的底部,否则会形成扭曲的条带。
不要过度填充样品池,如果样品溢入旁边的样品池,将会影响结果。 每个样品池装载 20-40μg 蛋白。
将凝胶浸泡在电泳缓冲液中,这些缓冲液通常包含 SDS,天然的凝胶电泳除外。
一个标准的 PAGE 电泳缓冲液,又叫运行(running)缓冲液,是1×氨基乙酸-甘氨酸
跑凝胶时按照厂家推荐的时间进行,这些可以随着仪器的改变而变更(根据电压,1 小时至过夜)。
当染料分子(“迁移前沿”)到达凝胶的底部,关闭电源。此时蛋白会从凝胶上慢慢的洗脱,因此不要保存在凝胶里,要迅速进行下一步的 转移操作。
内参的使用
内参是用来检测凝胶中的泳道是否载有相同的上样量。在比较不同样品的蛋白表达水平时这一点尤其重要。这对检查整个凝胶的平均转膜亦 十分重要。如有上样或转膜不平均的情况,内参对照可用来定量每条泳道的蛋白量。对于准备发表出版的试验,加入对照是绝对必需的。
|
|
内参 |
样品类型 |
分子量(kDa) |
注意事项 |
|
|
β肌动蛋白 |
全细胞/细胞质 |
43 |
不适用于骨骼肌样品,细胞生长条件的改变和细胞外基质成分 |
|
|
|
|
|
的相互作用可 能会改变肌动蛋白的合成(Farmer et al, 1983) |
|
|
GAPDH |
全细胞/细胞质 |
30-40 |
一些生理因素例如缺氧症和糖尿病会增强 GAPDH 在特定细胞 |
|
|
|
|
|
中的表达 |
|
|
微管蛋白 |
全细胞/细胞质 |
55 |
微管蛋白的表达随着抗菌和抗有丝分裂抗性药物而改变 |
|
|
|
|
|
(Sangrajrang S. et al, 1998, Prasad V et al, 2000)。 |
|
|
VDCA1/膜孔蛋白 |
线粒体 |
31 |
- |
|
|
COXIV |
线粒体 |
16 |
许多蛋白像 COXIV 出现在 16kDa 的位置 |
|
|
核纤层蛋白 B1 |
细胞核 |
66 |
不适合核膜被除去的样本 |
|
|
TATA 结合蛋白TBP |
细胞核 |
38 |
不适合 DNA 被除去的样本 |
|
|
|
|
|
|
三、蛋白转膜和染色
1、凝胶内蛋白的显色
蛋白显色的阶段非常重要,可以知道蛋白迁移的是否均匀、平坦。如果分离后的蛋白需要转膜,就用铜染,因为考马斯蓝染色是不可逆的。 考马斯蓝染色只用来检测转移的有效性,或者蛋白不需要转膜时,只用于观测蛋白 SDS-PAGE 分离的结果。
考马斯亮蓝染色
电源关闭,分离的蛋白带就会扩散,因为蛋白在溶液中是可溶的,为了防止扩散,凝胶中加入 40% 双蒸水、10% 醋酸、50% 甲醇,能使蛋 白质沉淀(变成不溶性的)。在上述溶液中加入 0.25% 考马斯亮蓝 R-250 使被固定的蛋白染色,在摇床上保持摇动,室温,4 小时至过夜。 转移凝胶至 67.5% 双蒸水、7.5% 醋酸、25% 甲醇混合物中(染料混合物保存起来,可多次重复使用)润洗,一直在摇床上震摇,中间更换 润洗液,直到洗去多余染料。染料不会结合到丙烯酰胺上,凝胶背景清晰,凝胶中的蛋白条带染成深蓝色。
铜染法
电泳凝胶用蒸馏水清洗数秒钟(最多 30 秒),然后转移至 0.3 M CuCl2 溶液中染色 5-15 分钟,再用去离子水洗一次,在暗背景下观察,在 蓝色胶背景下蛋白出现透明条带。
将胶置于 0.1- 0.25 M Tris/0.25 M EDTA pH 8.0 缓冲液中漂洗凝胶完全脱色,根据厂家说明再置于电转缓冲液中开始转膜。
2、蛋白转膜
- 详细的转膜操作可以在电转仪厂家的网页上找到,不同的系统操作也有区别。蛋白从凝胶至膜的转移应用的原理是电荷在电场中的迁移。
- 转膜方式分为半干转移和湿转移两种,半干式转膜速度快,而湿式转膜不会因为膜的干燥而失败,因此成功率高并特别适合用于分子量大 于100kDa 的蛋白。两种转膜方式都是膜紧贴凝胶,位于两层吸收材料之间,固体夹板夹在外面以保证膜和凝胶的紧密接触。
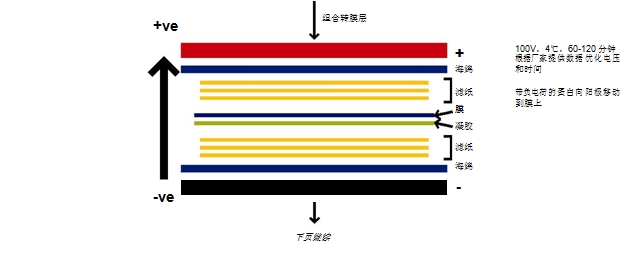
- 湿式转膜中膜和凝胶的三明治结构位于滤纸和海绵体之间(海绵/纸/胶/膜/纸/海绵),全部紧密排列,特别是胶/膜之间不能留有气泡。整 个三明治结构浸泡在转移缓冲液中,然后施加电场。带负电荷的蛋白向阳极移动。但膜阻挡了它们,并与其进行结合,从而阻止了它们的 继续移动。凝胶一般在 100V 条件下运行 1~2 小时,时间和电压可以优化,我们推荐根据厂家的说明进行操作。
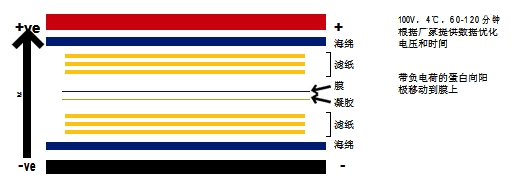
- 标准的湿转缓冲液和电泳缓冲液一样,为不含 SDS 的 1X Tris-gly 缓冲液,加入甲醇至终浓度 20%。如果转膜的蛋白分子量大 80kDa, 则推荐加入 SDS 使之终浓度为 0.1%。
- 半干式转膜中,三明治结构纸/凝胶/膜/纸用转移缓冲液浸湿,直接置于电转仪的正负极之间。在进行转移时,要注意一定要使膜紧贴阳极 而胶紧贴阴极。所用的电转缓冲液中 Tris 和甘氨酸的比例不一定和湿转的相同,需参考厂家的仪器说明书。标准配方是:48mM Tris、 39mM 甘氨酸、0.04% SDS、20% 甲醇。
- 两类膜可供选择:硝酸纤维素膜和 PVDF 膜(正电荷尼龙膜)。PVDF 膜需要小心地进行前处理:剪出大小合适的膜,在甲醇中浸泡 1-2 分 钟,再孵育于冰冷的电转缓冲液中5分钟。胶也需在冰冷的电转缓冲液中平衡 3-5 分钟,否则转膜时会起皱导致条带变形。
大蛋白和小蛋白转膜时的注意事项
电转移缓冲液中 SDS 与甲醇的平衡、蛋白大小、胶浓度都会影响转膜效果,如下调整可以增加转膜效果。
大蛋白(大于100 kDa)
- 对于大蛋白而言,其在凝胶电泳分离迁移较慢,而从凝胶转出也非常慢,因此对于这种大分子量蛋白应该用低浓度的凝胶,8%或更低, 但因低浓度的胶非常易碎,所以操作时需十分小心。
- 大蛋白易在凝胶里形成沉淀,从而影响转膜。转膜时在电转移缓冲液加入 SDS 至终浓度 0.1%,避免出现这种情况。甲醇易使 SDS 从蛋 白上脱失,因此相应降低甲醇的浓度至 10% 或更低,以防止蛋白沉淀。
- 降低电转移缓冲液中甲醇的比例,这样可以促进凝胶的膨胀,更易于大蛋白的转出。
- 只有使用硝酸纤维素膜时,甲醇才是必需的。如果是 PVDF 膜,甲醇可以不必加入电转移缓冲液中,但转膜前 PVDF 需用甲醇活化。
- 选择湿式,4℃ 转膜过夜,以取代半干式转膜。
小蛋白(小于100 kDa)
- SDS 阻止蛋白与膜的结合,小蛋白更是如此。因此,对于小分子的蛋白,电转移缓冲液中可以不加 SDS。
- 保持 20% 的甲醇浓度
避免手指直接接触膜,应使用镊子,手指上的油脂与蛋白会封闭转膜效率并易产生背景污斑。 在滤纸间排列凝胶和膜时,尽量用移液器或 15ml 试管赶除胶与膜之间的气泡,或在转移缓冲液中进行以防止气泡产生,请戴手套!确认裁剪的膜和滤纸与凝胶尺寸相同,边缘太大会导致在进行半干式转膜时电流不能通过膜。鸡抗体易与 PVDF 膜和其它尼龙膜结合,导致高背景,请替换成硝酸纤维素膜以降低背景。
3、膜上蛋白的显像:丽春红
为检测转膜是否成功,用 TBST 洗膜(TBST 溶液的配制详见 71 页缓冲液章节)。准备贮备液:2% 丽春红 S 溶于 30% 三氯乙酸和 30% 磺 基水杨酸,室温下震摇 5 分钟。1:10 稀释贮备液。
然后将膜浸泡在水中直至水变清且蛋白条带清晰。
用 TBST 或水重复洗膜直至膜完全脱色,PVDF 膜需用甲醇活化后再用 TBST 洗。
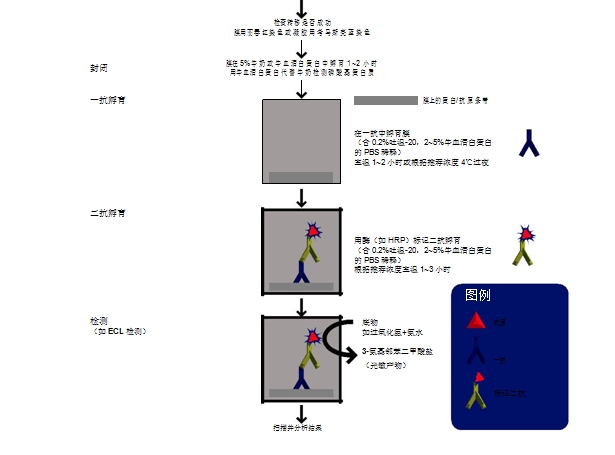
4、膜的封闭
有两种传统封闭液:脱脂奶粉或 BSA(Cohn 因子 V),脱脂奶粉成本低但不能用于磷酸化蛋白(因脱脂奶粉含有酪蛋白,该蛋白本身就是 一种磷酸化蛋白,会结合磷酸化特异性抗体而易产生高背景。)
为防止一抗或/和二抗与膜的非特异性结合,需要进行膜的封闭。
某些抗体用 BSA 封闭时可能会产生比脱脂奶粉更强的信号,请仔细阅读说明书,以确定有无特殊封闭膜方法。
用封闭缓冲液封闭 1 小时,4°C 震摇,封闭后用 TBST 洗 5 秒。
5、一抗的孵育
孵育缓冲液
按抗体说明书建议的稀释倍数,用 TBST 稀释一抗。如果说明书没有建议稀释倍数,则参照一般推荐的稀释倍数 (1:100-1:3000) 进行预试验,根 据试验结果选择合适稀释倍数,一抗浓度过高会导致产生非特异性条带。孵育缓冲液
某些实验室传统上在封闭液中孵育抗体,而有些实验室用不含封闭剂的 TBST 来孵育抗体,结果因抗体而异,有时两者结果相同,有时结果 不同。
孵育时间
一抗的孵育时间可从几小时至过夜(一般不超过 18 小时)不等,具体取决于抗体与蛋白的亲和性和蛋白的丰度,建议使用较高的抗体稀释 倍数和较长的孵育时间来保证特异性结合。
孵育温度
如果在封闭液中孵育过夜,应在 4oC 进行,否则污染会导致蛋白降解(特别是磷酸基团)。孵育一抗时需保持适当的摇动使之均匀覆盖膜,防 止结合不均匀。
6、二抗的孵育
一抗孵育结束后,用 TBST 摇动洗膜数次,每次 5 分钟或更长,去除残留的一抗。
孵育缓冲液和稀释:
按说明书推荐的倍数用 TBST 稀释二抗,如果说明书没有标出稀释倍数,则按常规的倍数稀释 (1:1000- 1:20,000) 预实验,二抗的浓度过高 也会导致非特异性条带。
可以在封闭液中孵育二抗(和一抗),但可能在降低背景同时导致特异性条带的信号也减弱,可能是封闭剂阻碍了抗体与靶蛋白的结合。
孵育时间和温度:
室温振荡 1-2 小时。
标记物:推荐使用 HRP 标记二抗,不建议使用 AP(碱性磷酸酶)标记二抗,因其不够灵敏。
7、显色方法
检测试剂盒:
HRP 标记二抗:传统上使用 ECL 和 ECL+(自制或购买),推荐使用后者。对于新一代检测仪器例如 Genegnome,请用仪器制造商推荐的试剂盒。
我们不推荐 ECL 或 BCIP/NBT 试剂盒,因为不够灵敏。
X-ray 胶片:
传统上使用手工曝光的方法,可控制 X-ray 胶片在曝光剂和定影剂的时间。而全自动 X-ray 胶片曝光器也已经广泛使用且操作简便。
五、蛋白印迹疑难解答提示
1、无信号
- 一抗和二抗不匹配
二抗需和一抗宿主的物种相同(如一抗来自兔,二抗为抗兔抗体)。
- 没有足够的一抗或二抗结合目标蛋白
使用高浓度抗体,延长 4℃ 孵育时间(如过夜)。
- 封闭剂与一抗或二抗有交叉反应
使用温和的去污剂如吐温-20,或更换封闭剂(常用的脱脂奶粉、BSA、血清或明胶)。
- 一抗不识别检测物种的蛋白
参照说明书,比对免疫原序列和蛋白序列以确保抗体和目的蛋白会发生反应,设置阳性对照。
- 抗原量不足
每泳道蛋白上样量不低于 20-30 μg,使用蛋白酶抑制剂并设置阳性对照。
- 组织中目的蛋白含量低
浓缩使信号最大化(例如检测核蛋白要用核裂解物)。
- 转膜不充分
使用可逆染色剂例如丽春红 S 检测转膜效果,检查转膜操作是否正确。PVDF 膜需预先浸在甲醇中,然后浸到转移缓冲液中。
- 洗膜过度
勿过度洗膜。
- 过度封闭使目标蛋白不能显色
代替 5% 脱脂奶粉,使用含 0.5% 脱脂奶粉或无脱脂奶粉的抗体稀释液,或更换封闭剂,减少封闭时间。
- 一抗失效
使用新鲜抗体,重复使用有效浓度会降低。
- 二抗受叠氮钠抑制
避免叠氮钠和 HRP 标记抗体一起使用。
- 检测试剂盒过期和底物失活
使用新鲜的底物。
2、背景高
- 未进行非特异性封闭或封闭不充分
延长封闭时间,考虑更换合适的封闭剂。Abcam 推荐 5% 脱脂奶粉、3% BSA 或血清封闭 30 分钟。这些可以包含在抗体缓冲液中。
- 一抗浓度过高
稀释抗体至合适浓度,以更高稀释度抗体孵育更长时间(耗时长但特异性结合最好)。
- 抗体孵育温度过高
4°C 孵育。
- 二抗与封闭剂非特异性结合或反应
设置二抗对照(不加一抗)。
- 一抗或二抗与封闭剂有交叉反应
在孵育和洗涤液中加入温和去污剂如吐温 -20。脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,会结合磷酸化特异性抗体而易产生 高背景。使用 BSA 代替奶粉作为封闭剂。
- 未结合蛋白质洗涤不充分
增加洗涤次数。
- 膜的选择导致的高背景
NC 膜比 PVDF 膜背景低。
- 膜干燥
在孵育过程中防止膜变干,在任何步骤都保证膜有充分的反应液,放入搅拌子不断搅动或轻轻振荡使膜浸在溶液中,避免出现干膜现象。
3、多带现象
- 细胞传代次数过多,使其蛋白表达不同
使用原始未传代的细胞株,和现在的细胞株一起做平行对照实验。
- 体内表达的蛋白样本具有多种修饰形式如乙酰化、甲基化、烷基化、磷酸化、糖基化等查阅文献,使用试剂使样品去磷酸化、去糖基化来验证翻译后的修饰。
- 蛋白样本降解(蛋白质分子量降低)
在样品缓冲液中加入足够的蛋白酶抑制剂。
- 检测到未经报道过的新蛋白或同一蛋白家族中具有相似表位而结构不同的蛋白
查阅其它文献报道,或 BLAST 搜寻,使用说明书推荐的细胞株或组织。
- 一抗浓度过高,高浓度时常出现多条蛋白带
降低抗体浓度和/或孵育时间。
- 二抗浓度过高,高浓度产生非特异性结合
降低抗体浓度,增加二抗对照(不加一抗)。
- 抗体未经纯化
使用亲和纯化的抗体,减少非特异条带。
- 条带为非特异性条带
应用封闭多肽来区分特异性和非特异性条带,只有特异性条带能被封闭从而消失。
- 靶蛋白形成多聚体
SDS-PAGE 电泳上样前,煮沸 10 分钟而不是 5 分钟,使蛋白质解聚。
3、背景有不均匀的白色斑点
- 转膜时膜上有气泡或抗体在膜上分布不均
转膜过程中尽量去除气泡,抗体孵育时保持摇动。
4、背景有黑色斑点
- 抗体结合了封闭剂
过滤封闭剂。
5、深背景出现白色条带(非预期背景)
- 一抗或二抗加入过多
稀释抗体的浓度。
6、分子量蛋白标准条带呈黑色
- 抗体和分子量蛋白标准发生了反应
在分子量蛋白标准和第一个样品之间增加一个空白条带。
7、目的条带染色过低/过高
- 分离不彻底
改变凝胶比例:分子量大的蛋白用低浓度胶,分子量小的蛋白用高浓度胶。
8、“微笑”条带
- 迁移过快
- 电泳温度过高(改变了 pH 值和迁移速度)
降低迁移速度或低温电泳(冷库或冰上)。
9、相同的蛋白杂交出现大小不均匀条带
- 制备凝胶时凝胶凝固太快,致使泳道中丙烯酰胺的比例不均匀
参照凝胶的配方,在凝胶中加入适量 TEMED,放置时在凝胶顶部加入适量 0.1% SDS(水稀释)以防凝胶变干。
10、凝胶染色不均匀
- 细菌污染
4°C 保存抗体并使用新鲜的缓冲液浸泡凝胶。
- 抗体量不足
确保在振荡孵育时抗体充分浸没膜。
六、常用试剂配置
- 裂解液
这些缓冲液可保存于4°C 几周,分装后冻存于-20°C 可以保存一年。
乙基苯基聚乙二醇(NP-40)缓冲液
150mM 氯化钠
1.0% 乙基苯基聚乙二醇(也可用0.1% 聚乙二醇辛基苯基醚(Triton X-100) 代替)
50mM 三羟甲基氨基甲烷-氯化氢(Tris-HCl),pH 值8.0
蛋白酶抑制剂
- RIPA缓冲液(放射免疫沉淀测定缓冲液)
150mM 氯化钠
1.0% 乙基苯基聚乙二醇或0.1% 聚乙二醇辛基苯基醚
0.5% 去氧胆酸钠
0.1% SDS(十二烷基硫酸钠)
50mM 三羟甲基氨基甲烷-氯化氢,pH 值8.0
蛋白酶抑制剂
注意:RIPA 缓冲液的变性能力要强于乙基苯基聚乙二醇或聚乙二醇辛基苯基醚,因其活性成分包含了离子型去垢剂SDS 和去氧胆酸钠,在核膜降解和细胞核提取时非常有用。RIPA 缓冲液产生的背景很低,但其也可使蛋白酶变性。
10% 的去氧胆酸钠储存液(5 克溶于50ml)必须避光保存。
- 三羟甲基氨基甲烷-氯化氢缓冲液
20mM 三羟甲基氨基甲烷-氯化氢,pH 值7.5
蛋白酶抑制剂
- 三羟甲基氨基甲烷-聚乙二醇辛基苯基醚缓冲液(用于细胞骨架蛋白)
10mM 三羟甲基氨基甲烷,pH 值7.4
100mM 氯化钠
1mM 乙二胺四乙酸
1mM 乙二醇双(2-氨基乙醚)四乙酸
1% 聚乙二醇辛基苯基醚
10% 甘油
0.1% 十二烷基硫酸钠
0.5% 去氧胆酸钠
蛋白酶抑制剂
- 非变性裂解缓冲液
20mM 三羟甲基氨基甲烷-氯化氢,pH 值8.0
137mM 氯化钠
10% 甘油
1% 乙基苯基聚乙二醇/聚乙二醇辛基苯基醚
2mM 乙二胺四乙酸
蛋白酶抑制剂
- 无去垢剂型可溶蛋白裂解液
5mM 乙二胺四乙酸
0.02% 叠氮化纳
磷酸盐缓冲液
蛋白酶抑制剂
一些可溶性蛋白不需要使用去垢剂。此缓冲液可用于机械裂解细胞,如用注射器反复抽压或用Dounce 匀浆机匀浆。
- 变性裂解液/用于不容于去垢剂的抗原的裂解液
1% 十二烷基硫酸钠
5mM 乙二胺四乙酸
使用前加入:
10mM 的二硫苏糖醇或β-巯基乙醇
蛋白酶抑制剂
15U/ml DNA 酶I
仅识别变性蛋白的抗体不会与天然型蛋白结合。在收集和裂解细胞时,要将重悬细胞的变性裂解缓冲液加热。此方法也可用于非离子型去垢剂无法提取的抗原。使用DNA 酶I 有助于从染色质中抽提蛋白。
- 电泳和印迹缓冲液
- Laemmli 2 倍缓冲液/上样缓冲液
4% 十二烷基硫酸钠
10% 2-巯基乙醇
20% 甘油
0.004% 溴酚蓝
0.125M 三羟甲基氨基甲烷-氯化氢测定pH 值,调整pH 值至6.8
- 电泳缓冲液
25mM 三羟甲基氨基甲烷碱
190mM 甘氨酸
0.1% 十二烷基硫酸钠
测定pH值,如有必要的话,调整pH 值至8.3
- 转移缓冲液(湿式)
25mM 三羟甲基氨基甲烷碱
190mM 甘氨酸
20% 甲醇
如有必要的话,pH 值应调节至8.3
大于80 kDa 的蛋白,建议十二烷基硫酸钠终浓度为0.1%。
- 转移缓冲液(半干式)
48mM 三羟甲基氨基甲烷
39mM 甘氨酸
20% 甲醇
0.04% 十二烷基硫酸钠
- 封闭缓冲液
5% 牛奶或BSA(牛血清白蛋白)
加入三乙醇胺-吐温缓冲液。充分混合后过滤。如不过滤会聚集成斑点,这种小暗点会在显色时影响印迹的效果。
声明:以上内容由Abcam公司提供。
| 序号 | 最新资讯 | 浏览次数 | 发布时间 |
| 1 | WB流程视频及常用Buffer的配方 | 1313 | 2017-12-16 |
| 2 | WB 实验方案大全 | 3187 | 2017-12-15 |
| 3 | 免疫沉淀实验方案大全 | 993 | 2017-12-14 |
| 4 | ELISA 实验方案大全 | 1233 | 2017-12-14 |
| 5 | 免疫组化实验方案 | 2086 | 2017-12-14 |