一、研究背景
细胞因子(Cytokines,CKS)是一类多肽及蛋白的总称,包括白细胞介素和干扰素,集落刺激因子等,参与各种免疫细胞的生长、分化和功能发挥。细胞因子是细胞间普遍存在的信使,起局部或系统调节作用,细胞因子多数是可诱导性的,在各种刺激因素作用下,多种细胞快速合成并分泌细胞因子。正常情况下,细胞因子表达和分泌受机体严格的调控,在病理状态下,细胞因子会出现异常性表达,表现为细胞因子及其受体的缺陷、细胞因子表达过高,以及可溶性细胞因子受体的水平增加等。通过检测细胞因子的变化,可以发现或指导疾病的治疗,例如风湿关节炎的滑膜液中可发现IL-1、IL-6、IL-8水平明显高于正常人,而这些细胞因子均可促进炎症过程,使病情加重。应用细胞因子的抑制剂有可能治疗这类炎症性细胞因子水平升高的疾病。研究包括:感染性疾病研究,肿瘤疾病研究,风湿免疫疾病研究,自身免疫性疾病研究等。
二、基本原理
细胞因子检测是判断机体免疫功能的一个重要指标,因而具有重要的实验室研究价值,同时还可能在临床上有诸多实用价值,包括许多疾病的诊断、病程观察、疗效判断及细胞因子治疗监测等。但是,由于细胞因子在体内的含量甚微,给细胞因子的检测带来困维。
目前细胞因子的检测方法有多种,流式作为免疫检测的高灵敏度仪器,利用抗原抗体反应的原理,可进行细胞因子的免疫检测。结合表面染色分群,通过检测细胞因子的表达情况,可以反映不同细胞的分化状态和激活状态。此外,胞内检测对于研究特殊刺激剂的免疫效果有独特的优势。这种方法的优点是特异性强、操作简便,有良好的发展前景。
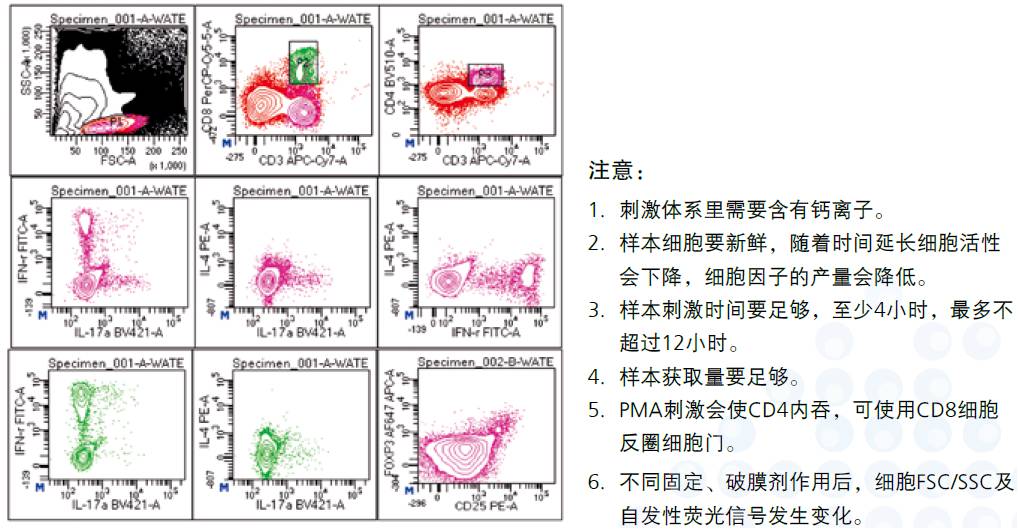
本试验根据合成的细胞因子不同将T细胞分为各种亚群。首先用刺激剂使细胞分泌细胞因子,同时加入莫能霉素或BFA阻断细胞因子的外排,使细胞因子在胞内聚集,再采用合适的固定剂、透膜剂,从而检测刺激细胞内部的细胞因子、转录因子。
三、研究方法
1、主要实验材料和设备
- 全血细胞或PBMC样本(悬浮于含钙的PBS)
- 普通低速离心机 (实验要求为300g~600g,可调转速可调时间,能离心12x75mm的5ml试管),最好为水平转子
- 12x75mm的5ml 流式管
- 固定或可调节的加样器及相应加样头若干:2ul,20ul,100ul,200ul,1ml
- 旋涡混匀器
- 300目过滤尼龙网
- 可放置12x75mm的5ml试管的试管架2-3个
- PBS溶液和蒸馏水:0.22μm滤膜过滤
- BD FACS流式细胞仪,配置4B-2R-2V
2、实验前准备
- 仪器质控CST,各通道PASS
- 调节细胞孵箱或水浴至37°C
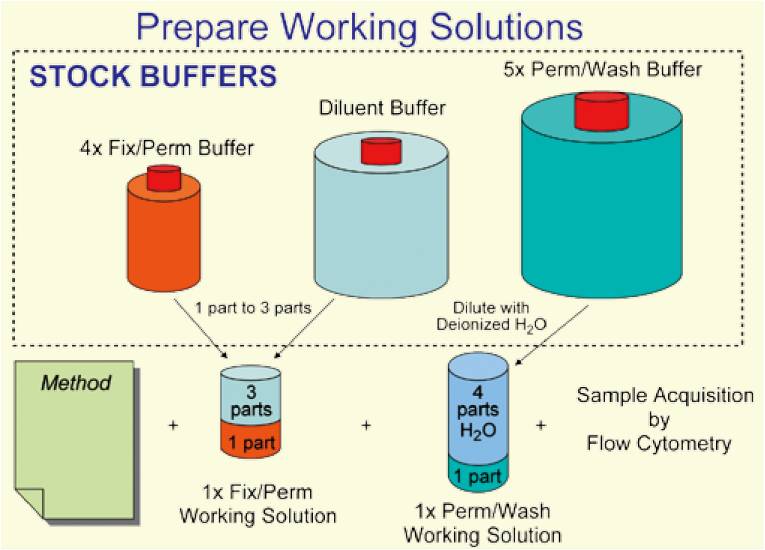
- 配置buffer,置于4°C保存,配置过程如下图所示:
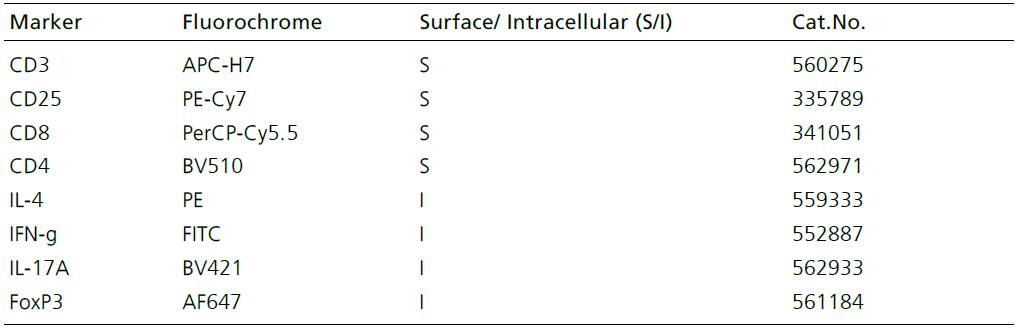
3、BD 流式抗体
其他辅助试剂

4、样本管设置
未刺激样本管(US)、刺激样本管(SS)
(未刺激样本管,除细胞不刺激外,其他处理同刺激样本)

阴性对照管: US未染色管,US染色8色管
单阳管设置: 由于胞内细胞因子的表达水平可能较低,用细胞直接做单染处理,不能获得足够的单染阳性细胞群。建议采用BD补偿微球(CompBeads)做单染样本,调节荧光通道之间的补偿。
补偿微球(CompBeads)的使用:准备9个流式管,每个流式管均加1滴阴性补偿微球(NegativeBeads),1滴阳性补偿微球(CompBeads),除第一管外,其余每管分别加入一种荧光相应的抗体(1 Test体积或0.5μg)。
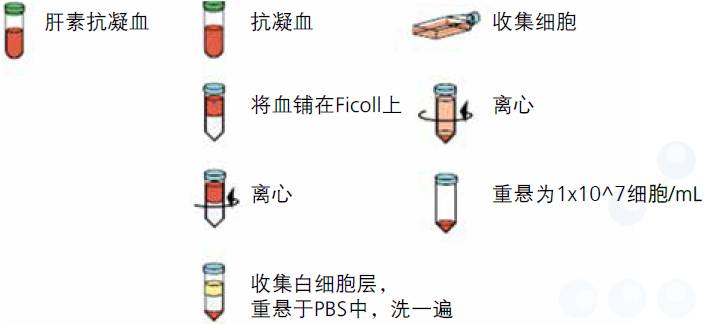
5、样本制备流程图(分别为全血、PBMC、培养细胞)
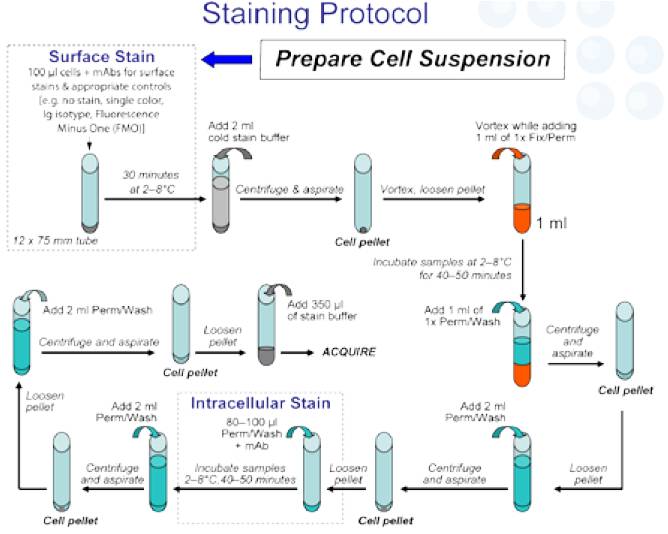
表面染色、固定及破膜:
刺激后直接进行表面染色,后续过程如下图:
5.1 外周全血样本处理过程
- 取血:肝素钠真空抗凝采血管取人外周血全血1-2ml,血液室温放置,8 小时内进行检测,否则弃用。
- 刺激细胞活化:每个样本管分别加入200μL抗凝全血(裂解红细胞后,白细胞浓度达到2×10^6细胞/mL),
- 每样本管加入4μl BD Leukocyte Activation Cocktail with BD GolgiPlug (刺激剂和蛋白转运抑制剂),混匀。37°C,5% CO2培养箱或37°C水浴孵育4-6小时。
- 细胞表面标记染色:向样本管加入相应体积的CD3, CD4, CD8, CD25抗体(依据样本不同,需要滴定抗体浓度),室温避光孵育15-30分钟。
- 制备1X红细胞裂解液:取10X红细胞裂解液,按照体积1(10X红细胞裂解液):9(dH2O),稀释。
- 裂解红细胞:每100ul全血加入2ml 1X红细胞裂解液,室温裂解8-12min,至细胞悬液呈澄清透明状。
- 裂红后,500g,离心5分钟,洗涤细胞,离心后弃上清。加入1ml Staining Buffer,500g,离心5分钟,洗涤细胞,离心后弃上清。
- 缓冲液制备 (BD Transcription Factor Buffer Set),现用现配
1体积 TF Fix/Perm Buffer (4X),3体积TF Diluent Buffer,1:3混合,配制成1X TF Fix/Perm Working Solution;
1体积 TF Perm/Wash Buffer(5X),4体积 dH2O,1:4混合,配制1X Perm/Wash Working Solution。
- 细胞固定、破膜:重悬细胞,每管加入1 ml新鲜配制的1X TF Fix/Perm Working Solution,涡旋混匀,2-8°C避光孵育40-50分钟。
- 每管直接加入1 ml 1X Perm/Wash Working Solution到固定的细胞中,2-8°C 500g 离心5分钟,弃上清。每管加入2 ml 1X Perm/Wash Working Solution,2-8°C 500g离心5分钟,弃上清。
- 胞内染色:每管加入80-100ul 1X Perm/Wash Working Solution,同时加入相应的IL-4,IFN-g,IL-17A,FoxP3,涡旋混匀,2-8°C 避光孵育40-50分钟。
- 涡旋细胞,每管加入2 ml 1X Perm/Wash Working Solution,2-8°C 500g离心5分钟,弃上清。
- 重复第11步骤一次,每管加入500ul PBS洗液,上机检测即可。
5.2 PBMC样本处理过程
- 肝素钠真空抗凝采血管取人外周血全血,用Ficoll (GE公司)淋巴细胞分离液分离PBMC。
- PBMC制备请参考Ficoll产品使用说明书。
- 将分离后的PBMC用PBS(含钙离子)洗涤,500g,5min,离心弃上清
如果样本当天不检测,可以在液氮条件下冻存:10%DMSO+90%胎牛血清
如果当天检测,用PBS重悬细胞,调整浓度至1-2x10^7细胞/ml。
- 将200μl 细胞悬液(2x10^6细胞)转移至12 x 75 mm 圆底流式管中。
- 刺激细胞活化:向每个样本管加入4μl BD Leukocyte Activation Cocktail with BD GolgiPlug (刺激剂和蛋白转运抑制剂),混匀。37°C,5%CO2培养箱或37°C水浴孵育4-6小时(不超过6个小时)。
- 细胞表面标记染色:向样本管加入相应体积的CD3, CD4, CD8, CD25抗体(依据样本不同,需要滴定抗体浓度),室温避光孵育15-30分钟。
- 加入1ml Staining Buffer,500g,离心5分钟,洗涤细胞,离心后弃上清。
- 缓冲液制备 (BD Transcription Factor Buffer Set4),现用现配
1体积 TF Fix/Perm Buffer (4X),3体积TF Diluent Buffer,1:3混合,配制成1X TF Fix/Perm Working Solution
1体积 TF Perm/Wash Buffer(5X),4体积dH2O,1:4混合,配制1X Perm/Wash Working Solution
- 细胞固定、破膜:重悬细胞,每管加入1 ml新鲜配制的1X TF Fix/Perm Working Solution,涡旋混匀,2-8°C避光孵育40-50分钟。
- 每管直接加入1 ml 1X Perm/Wash Working Solution到固定的细胞中,2-8°C 500g 离心5分钟,弃上清。
- 每管加入2 ml 1X Perm/Wash Working Solution,2-8°C 500g离心5分钟,弃上清。
- 胞内染色:每管加入80-100ul 1X Perm/Wash Working Solution,同时加入相应的IL-4, IFN-g,IL-17A,FoxP3后,涡旋混匀,2-8°C 避光孵育40-50分钟。
- 涡旋细胞,每管加入2 ml 1X Perm/Wash Working Solution,2-8°C 500g离心5分钟,弃上清。
- 重复第13步骤一次,每管加入500ul PBS洗液,上机检测即可。
6 、上机检测(以Diva软件为例):
- 仪器质控:使用CST微球按照操作手册进行仪器质控。
- 在Diva软件中依次创建New Folder> Experiment > Speciman > Tube。
- 在Parameters窗口中保留:APC-Cy7、PE-Cy7、PerCP-Cy5.5、BV510、PE、FITC、BV421、AF647。
- 上US未染色管,调节各通道电压,使样本荧光强度高于各荧光通道的最低检测范围(不记录)。
- 在菜单栏中选择Experiment> Compersation Setup> Create Compersation Controls,点击OK。自动生成名称为Compensation Control的Speciman,包含阴性对照管(NegativeBeads)及各单阳补偿管(CompBeads);
在Normal Worksheet中自动生成阴性对照管及各单阳补偿管的获取模板。
- 上Negative Tube(CompBeads),调节FSC/SSC电压,使P1门圈中样本群,单击右键,将P1门应用到所有补偿对照管(不记录);将各单阳管依次上样,调整电压,确认阳性群低于各荧光通道的最高检测范围
- Compensation Tubes顺序上样,依次记录各CompBead管,调整P1和P2位置,在菜单栏中选择Experiment > Compersation Setup> Calculate Compersation,重新命名补偿名称,并链接应用补偿。
- 依次记录实验的US未染色管、US染色8色管、刺激样本管。
7、实验结果
| 序号 | 最新资讯 | 浏览次数 | 发布时间 |
| 1 | PI 细胞周期检测试剂盒(含RNase A) | 132 | 2024-12-24 |
| 2 | 流式辅助试剂与耗材 | 426 | 2017-12-26 |
| 3 | 胞内染色专题 | 1579 | 2017-12-26 |
| 4 | 流式技术检测磷酸化蛋白的新方法 | 847 | 2017-11-29 |
| 5 | 多色流式荧光素搭配的选择 | 795 | 2017-11-29 |