【产品简介】
本试剂盒采用高效、专一结合核酸的离心吸附柱和独特的缓冲系统,适合从各种不同的新鲜或冻存植物组织中提取基因组DNA,并 可最大限度去除植物组织中的杂质。本试剂盒无需使用酚/氯仿抽提,操作安全。提取的基因组DNA片段大、纯度高、质量稳定可靠, 适用于 PCR、荧光定量 PCR、分子标记、文库构建等实验。
【储存条件】 室温保存
【自备试剂】 无水乙醇。
【实验前准备及注意事项】
1. 样品应避免反复冻融,否则会导致提取的DNA片段较小且提取量下降。
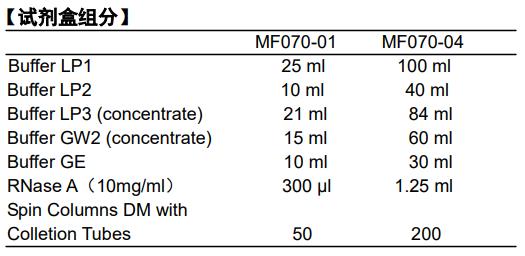
2.第一次使用前应按照试剂瓶标签的说明在Buffer LP3 (MF070-01应该加27ml无水乙醇,MF070-04应该加108ml无水乙醇)和Buffer GW2 (MF070-01应该加45ml无水乙醇,MF070-04应该加180ml无水乙醇)中加入无水乙醇。使用前请检查Buffer LP1和Buffer LP2是否出现结晶或者沉淀,如有结晶或者沉淀,请将Buffer LP1和Buffer LP2于56˚C水浴重每个新溶解。
【操作步骤】
1. 取植物新鲜组织100 mg左右或干重组织约20 mg,加入液氮充分研磨。
2. 将研磨后的粉末收集到离心管(自备)中,加入400 μl Buffer LP1和6 μl RNase A(10 mg/ml),涡旋振荡1分钟,室温放置10 分钟,使其充分裂解。
注意:
1)使用涡旋振荡或移液器吹打,充分裂解组织,组织裂解不完全会影响最终的DNA得率。
2)请勿在使用前将Buffer LP1与RNase A混合。
3. 加入130 μl Buffer LP2,混匀,涡旋震荡1分钟。
4.12,000 rpm(~13,400×g)离心5分钟,将上清移至新的离心管(自备)中。
5.加入1.5倍体积的Buffer LP3(使用前检查是否已加入无水乙醇),充分混匀(如500 μl滤液加入750 μl Buffer LP3)。
注意:加入Buffer LP3后应立即混匀,可能会产生沉淀但不影响后续实验。
6.将上步所得溶液和沉淀全部加入到已装入收集管的吸附柱(Spin Columns DM)中,若一次不能加完溶液,可分多次转入。12,000 rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。
7.向吸附柱中加入500 μl Buffer GW2(使用前检查是否已加入无水乙醇),12,000 rpm离心1分钟,倒掉收集管中的废液,将吸附柱 重新放回收集管中。
注意:如吸附膜呈现绿色,向吸附柱中加入500 μl无水乙醇,12,000 rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收 集管中。
8.重复步骤7.
9.12,000 rpm离心2分钟,倒掉收集管中的废液。将吸附柱置于室温数分钟,以彻底晾干。
注意:这一步的目的是将吸附柱中残余的乙醇去除,乙醇的残留会影响后续的酶促反应(酶切、PCR 等)。
10.将吸附柱放到一个新离心管(自备)中,向吸附膜的中间部位悬空滴加50-100 μl Buffer GE或灭菌水,室温放置2-5分钟,12,000 rpm 离心1分钟,收集DNA溶液。-20˚C保存DNA。
注意:
1)如果下游实验对pH值或EDTA敏感,可以用灭菌水洗脱。洗脱液的pH值对洗脱效率有很大影响,若用水做洗脱液应保证 其pH值在7.0-8.5(可以用NaOH将水的pH值调到此范围),pH值低于7.0时洗脱效率不高。
2)离心之前室温孵育5分钟可以增加产量。
3)如果要提高DNA的终浓度,可以将步骤10所得的DNA洗脱液重新加至吸附膜上,重复步骤10;若洗脱体积小于100 μl, 可以增加DNA的终浓度,但可能会减少DNA的总产量。如果所得DNA的量小于1 μg,推荐用50 μl Buffer GE进行洗脱。
4)因为保存在水中的DNA会受到酸性水解作用的影响,如需长期保存,推荐用Buffer GE洗脱并于-20˚C保存。
|
货号 |
规格 |
销售价 |
|
MF070-01 |
50T |
598.00 |
|
MF070-04 |
200T |
1698.00 |
| 序号 | 最新资讯 | 浏览次数 | 发布时间 |
| 1 | (0.1-20ml) 非柱式血液基因组DNA小量提取试剂盒 | 38 | 2023-01-28 |
| 2 | 微量/临床基因组DNA快速提取试剂盒 | 36 | 2023-01-27 |
| 3 | 酵母基因组DNA提取试剂盒 | 40 | 2023-01-27 |
| 4 | 多糖多酚植物基因组DNA提取试剂盒(离心柱法) | 60 | 2023-01-27 |
| 5 | 真菌基因组DNA提取试剂盒 | 45 | 2023-01-27 |